
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Список литературы
Дата: 07.05.2020 г.
Группа: А-210
Дисциплина: Физика
Тема: 165-166
Урок: Модель атома водорода по Н. Бору
На уроке рассматриваются следующие вопросы: постулаты Бора, условие стационарности орбиты (правило квантования), скорость электрона и радиус n-ной стационарной орбиты.
Модели атомов Резерфорда и Томсона
В 1911 году Резерфорд предложил планетарную модель атома, когда работал в лаборатории Дж. Томсона, проверяя достоверность его модели (рис. 1).
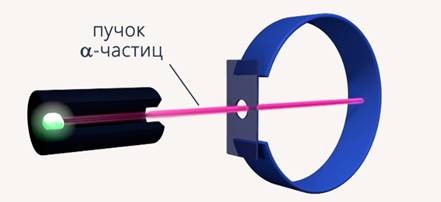
Рис. 1. Траектория частиц без золотой пластины
Внутрь свинцового цилиндра с узким отверстием был заложен радий. При помощи диафрагмы создавался узкий пучок -частиц, которые, пролетая через отверстие диафрагмы, попадали на экран, покрытый специальным составом, и наблюдалась сцинтилляционная вспышка. Все частицы, которые вылетали из цилиндра, попадали в одну точку. Когда на пути летящих -частиц была поставлена золотая пластина (рис.2), только небольшая часть 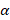 -частиц начали отклоняться от первоначальной траектории.
-частиц начали отклоняться от первоначальной траектории.
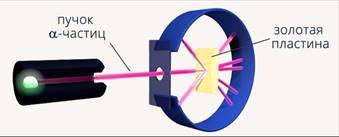
Рис. 2. Траектория частиц в присутствии золотой пластины
Из фундаментальных опытов, которые провел Резерфорд, следовало, что в состав атома входит очень небольшая положительно заряженная частица, несущая почти всю массу атома (рис. 3). Это противоречило модели Томсона, в которой электроны были распределены в положительно заряженной массе (рис. 4).
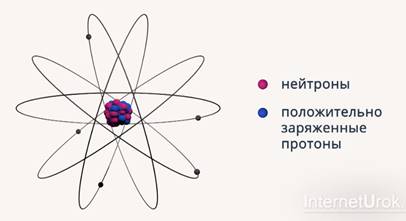
Рис. 3. Модель атома Резерфорда

Рис. 4. Модель атома Томсона
Резерфорд решил, что в центре атома находится положительно заряженное ядро, вокруг которого вращаются электроны (рис. 3). Но так как данная модель противоречила классической электродинамике, Резерфорд ее снял.
Противоречие заключалось в следующем: так как каждая ускоренно движущаяся частица излучает в пространство электромагнитные волны, при этом она теряет свою энергию. По этой логике, электрон, двигаясь ускоренно, теряет энергию и должен свалиться на ядро. Но атом является устойчивым образованием, и этого не происходит.
Модель атома Бора
Дальнейшее развитие физики взял на себя Нильс Бор. Он предложил свою модель атома в 1913 году.
Бор знал, что размер атома во много раз больше размера ядра:
1. Размер атома: 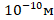 .
.
2. Размер ядра: 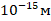 .
.
Размер ядра в 100 000 раз меньше размера атома. Это и натолкнуло Бора назвать свою модель планетарной, поскольку соотношение между размером Солнца и Солнечной системы приблизительно такое же.
Также он знал, что энергия излучается отдельными квантами:
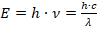 – формула Планка
– формула Планка
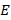 – излучаемая энергия, Дж;
– излучаемая энергия, Дж;
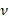 – частота излучения, Гц;
– частота излучения, Гц;
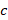 – скорость света (
– скорость света ( 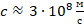 );
);
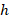 – постоянная Планка (
– постоянная Планка ( 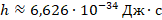 );
);
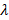 – длина волы излучения, м.
– длина волы излучения, м.
Также были известны серии в спектре атома водорода:
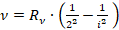 , где
, где 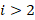 – И. Бальмер, 1885 г.
– И. Бальмер, 1885 г.
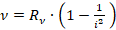 , где
, где 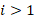 – Т. Лайман, 1906 г.
– Т. Лайман, 1906 г.
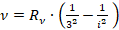 , где
, где 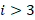 – Ф. Пашен, 1908 г.
– Ф. Пашен, 1908 г.
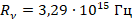 – коэффициент пропорциональности
– коэффициент пропорциональности
В основу своей модели строения атома Нильс Бор положил два постулата.
1-й постулат: существуют стационарные орбиты, находясь на которых, электрон не излучает и не поглощает энергию.
2-й постулат:изучение энергии происходит при переходе электрона с одной стационарной орбиты на другую в виде кванта света (излучения).
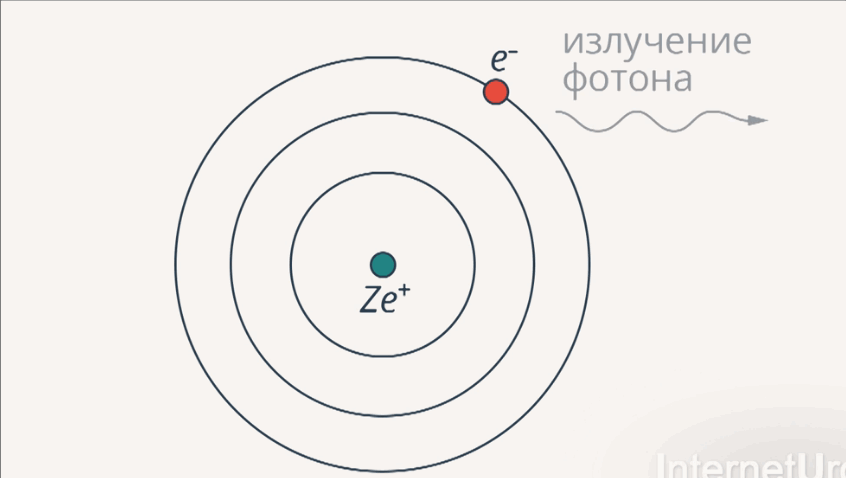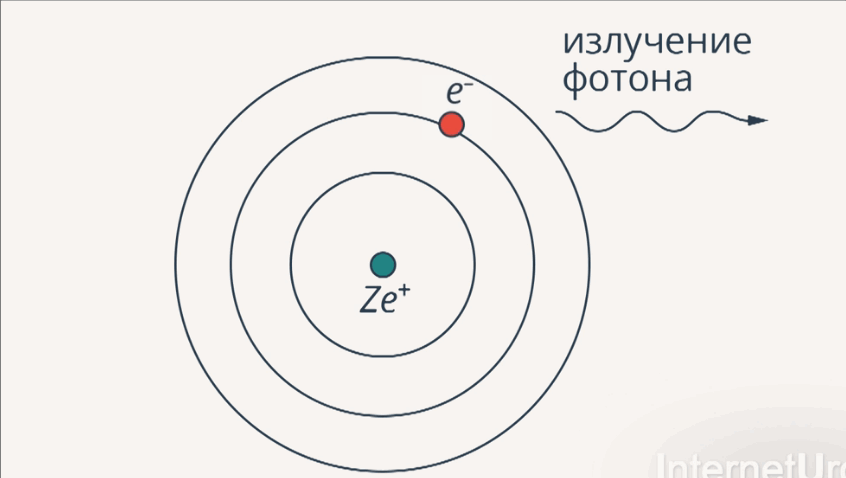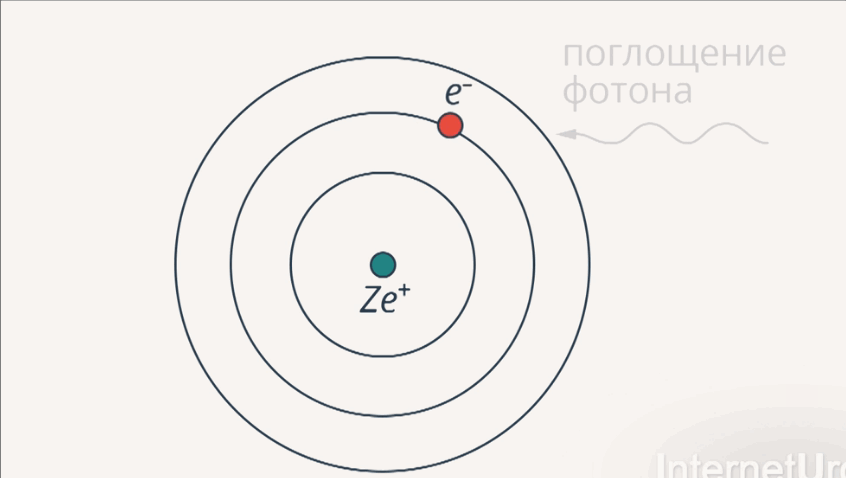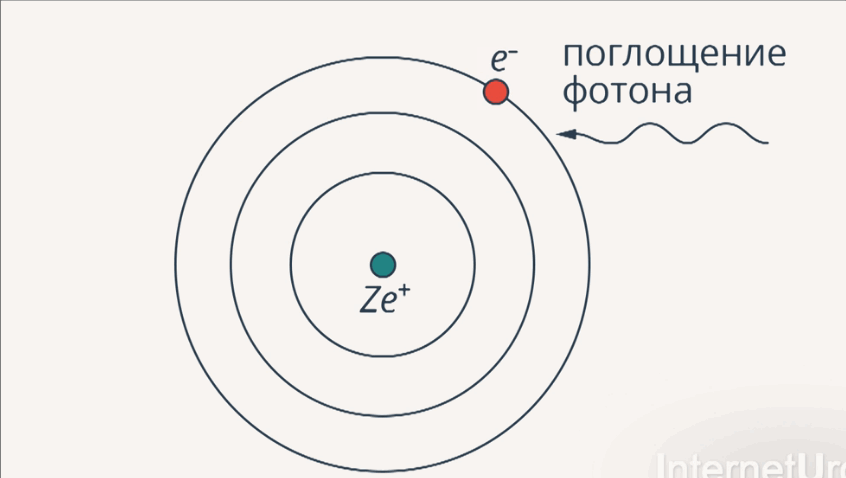
Рис. 5. Излучение и поглощение фотона
Правило квантования орбиты
Чтобы согласовать свою теорию с экспериментальными фактами излучения атома водорода, Бор обнаружил, что момент импульса электрона на стационарной орбите всегда кратен квантовой постоянной Планка.
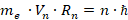
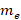 – масса электрона;
– масса электрона;
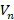 – скорость движения электрона по орбите;
– скорость движения электрона по орбите;
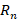 – радиус атома;
– радиус атома;
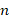 – главное квантовое число;
– главное квантовое число;
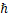 – квантовая постоянная Планка.
– квантовая постоянная Планка.
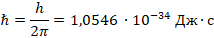
Модель водородоподобного атома Бора
Бор составил систему уравнений, по которым видно, что данная модель является полуклассической. Электрон движется по круговой орбите вокруг положительно заряженного ядра. В центре атома находится положительно заряженное ядро с зарядом 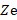 (где
(где 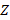 – порядковый номер элемента) (рис. 6).
– порядковый номер элемента) (рис. 6).
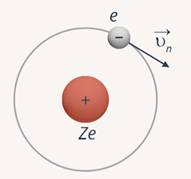
Рис. 6. Водородоподобный атом
Теория Бора оказалась применима только к водородоподобному атому. Данная теория была проверена для однократно ионизированного гелия, т. е. гелия с одним электроном на орбите. На электрон действует сила электростатического взаимодействия с ядром, данная сила является центростремительной (рис. 7).
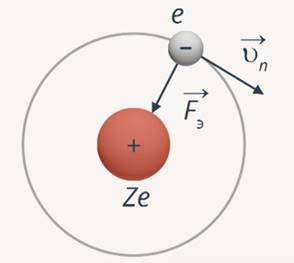
Рис. 7. Сила электростатического взаимодействия
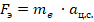
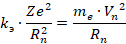
Бор составил систему уравнений:
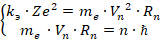
Данная система содержит две неизвестных. Первая из них – это радиус n-й орбиты ( 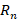 ), вторая – скорость электрона на этой n-й орбите (
), вторая – скорость электрона на этой n-й орбите ( 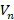 ).
). 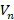 получается делением первого уравнения на второе:
получается делением первого уравнения на второе:
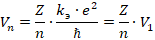
Подставив 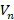 во второе уравнение системы, можно получить выражение для
во второе уравнение системы, можно получить выражение для 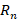 :
:
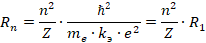
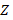 – заряд ядра;
– заряд ядра;
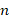 – номер орбиты;
– номер орбиты;
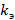 – коэффициент пропорциональности из закона Кулона;
– коэффициент пропорциональности из закона Кулона;
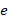 – элементарный электрический заряд;
– элементарный электрический заряд;
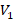 – скорость электрона на первой орбите;
– скорость электрона на первой орбите;
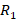 – радиус первой орбиты в атоме водорода;
– радиус первой орбиты в атоме водорода;
В атоме водорода при 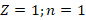 :
:
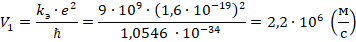
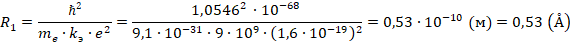
Соответственно, диаметр первой орбиты равен: 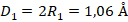 , где Å – ангстрем (единица измерения атомных размеров)
, где Å – ангстрем (единица измерения атомных размеров)
Список литературы
1. Соколович Ю.А., Богданова Г.С. Физика: справочник с примерами решения задач. – 2-е издание, передел. – X.: Веста: издательство «Ранок», 2005. – 464 с.
2. Мякишев Г.Я., Буховцев Б.Б. Чаругин В.М. Физика 11 кл.: учебник для общеобразовательных учреждений. – 23-е изд. – М.: Просвещение, 2014. – 400 с.
Дополнительные рекомендованные ссылки на ресурсы сети Интернет
1. Интернет-портал «bibliotekar.ru» (Источник)
2. Интернет-портал «eduspb.com» (Источник)
3. Интернет-портал «eduspb.com» (Источник)
Домашнее задание
1. В чем различие между моделями атомов Резерфорда и Бора?
2. Определите радиус первой боровской орбиты и скорость электрона атома водорода на ней.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|