
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Общие способы получения металлов
28/04/20г. Урок № 62
Общие способы получения металлов
Смотреть по ссылке урок: https://www.youtube.com/watch?v=hrYXHEyLPKg
!Записать всё в тетрадь для работ выполнить задание!
Металлы присутствуют в природе как в самородном состоянии (самородные металлы), так и в виде различных соединений. В свободном состоянии присутствуют в природе металлы, которые либо плохо окисляются кислородом, либо совсем не окисляются. Например, платина, золото, серебро. Но чаще всего металлы существуют в природе в связанном состоянии в составе минералов.
Минерал– это химически и физически индивидуализированный продукт природной физико-химической реакции, находящийся в кристаллическом состоянии.
Активные металлы часто присутствуют в природе в виде солей (сульфаты, нитраты, хлориды, карбонаты). Минералы входят в состав горных пород и руд. Существуют различные способы обогащения руды. Один из них флотация.
Пирометаллургически получают(методы извлечения металлов из руд под действием высоких температур. Оксидные руды и оксиды восстанавливают углем, оксидом углерода (II), более активным металлами (алюминий, магний)): чугун, сталь, медь, свинец, никель, хром и другие металлы.
Для получения металлов из руд необходимо перевести металлы из руд в какую-нибудь единую форму, чаще всего в форму оксидов.
2CuS +3 O2 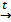 2CuO + 2SO2
2CuO + 2SO2
4FeS2 +11O2 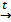 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
Полученные оксиды можно восстанавливать несколькими способами.
1. Один из основных - это металлотермия.
- Алюмотермия (алюминотермия)
Cr2O3 +2 Al 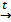 2Al2O3 + 2Cr
2Al2O3 + 2Cr
- Магниетермия.
Fe2O3 +3Mg 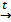 3MgO + 2Fe
3MgO + 2Fe
Можно проводить восстановление и другими веществами.
CuO + C → Cu + CO↑
NiO + H2 → Ni + H2O
2. Термическое разложение соединений металлов.
2AlH3 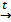 2Al + 3H2↑
2Al + 3H2↑
Fe(CO)5 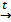 Fe + 5 CO ↑
Fe + 5 CO ↑
TiI4 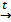 Ti + 2I2
Ti + 2I2
Этот метод применяется для получения высокочистых металлов.
3. Электролитическое получение металлов.
Металлы, особенно, активные можно получить при электролизе расплавов электролитов. Для щелочных металлов – это единственный способ их получения.
СuСl2 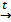 Сu2+ + 2Сl-
Сu2+ + 2Сl-
Катод (восстановление): Анод (окисление):
Сu2+ + 2е- = Сu° 2Cl - - 2е- = Сl°2
Электрометаллургически получают(выделение металлов из их солей и оксидов под действием электрического тока): щелочные и щёлочноземельные металлы, алюминий, магний и другие металлы.
4. Более активный металл вытесняет менее активный из раствора его соли.
CuSO4 + Fe → FeSO4 + Cu
В таких реакциях нельзя использовать щелочные и щелочноземельные металлы, потому что они реагируют с водой.
5.Гидрометаллургически получают(методы получения металлов, основанные на химических реакциях, протекающих в растворах): золото, цинк, никель и некоторые другие металлы.
CuSO4 + Fe → FeSO4 + Cu
Домашнее задание:
1. Из оксида железа Fe3O4 (железная окалина FeO∙Fe2O3 смесь оксидов) можно получить железо алюминотермическим способом. Составьте уравнение этой реакции и покажите переход электронов, т.е. рассмотрите её как окислительно-восстановительную реакцию.
2. Составьте уравнения реакций, при помощи которых можно получить железо из пирита FeS2. Проставьте степени окисления и покажите переход электронов.
3. Закончите схему реакции: Fe3O4 + ... → Fe + H2О
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|