
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Запишите конспект в рабочую тетрадь. Выучите конспект.
18.05.20
1. Запишите конспект в рабочую тетрадь. Выучите конспект.
2. Разместите конспект в комментариях к уроку до 12-50.
Фамилия Имя обучающегося
Тема 61, 62. Класс Алкены
(непредельные углеводороды ряда этилена, олефины)
Алкены -углеводороды с общей формулой CnH2n, в молекулах которых между атомами углерода есть одна двойная связь. Представитель – этилен (этен) - С2Н4 или СН2 = СН2.
Строение этилена и Алкенов:
| 1) sp2 – гибридизация; | 4) Молекула имеет плоскую форму |
| 2) Валентный угол 120о | 5) Общая формула CnH2n |
| 3) Ординарные связи (3σ - связи)и одна двойная связь (π - связь) | 6) Расстояние между атомами углерода 0,134 нм |
Гомологический ряд Алкенов
Гомологи –вещества, имеющие сходное строение и свойства, но отличающиеся друг от друга на одну или несколько гомологических разниц (- СН2).
| С2Н4 - этен |
| С3Н6 – пропен… |
Изомерия у Алкенов
1. Изомерия по разветвлению углеродной цепи. Изомеры пентена С5Н10:
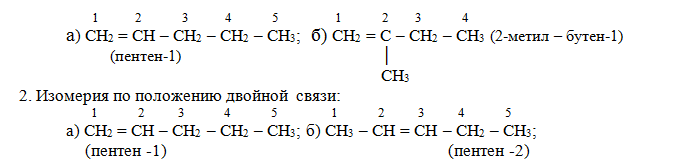
Физические свойства Алкенов
Этилен – бесцветный газ, почти без запаха, легче воздуха, плохо растворим в воде.
Химические свойства Алкенов
1) Горение на воздухе: С2Н4 + 3О2 → 2СО2 ↑+ 2Н2О;
2) Окисление окислителями (KMnO4):
СН2 = СН2 + [О]+ Н2О → НО ― СН2 ― СН2 ― ОН (этиленгликоль);
3) Реакции присоединения:
А) с водородом – гидрирования: С2Н4 + Н2 → С2Н6;
Б) с галогенами (галогенирование): С2Н4 + Br2 → С2Н4 Br2;
В) с галогеноводородами (гидрогалогенирование): С2Н4 + НBr → С2Н5 Br;
Правило Марковникова: водород присоединяется к наиболее гидрированному атому углерода, а атом галогена – к наименее гидрированному атому углерода:
СН2 = СН ― СН3 + НBr → СН3 ― СНBr ― СН3;
4) с водой – реакция гидратации:С2Н4 + НОН → С2Н5 ОН;
5) Реакции полимеризации: СН2 = СН2 + СН2 = СН2 + … → (― СН2 ― СН2 ―)n (полиэтилен).
Получение алкенов
1) из этилового спирта: С2Н5 ОН → С2Н4 + НОН (реакция дегидратации)
2) из Алканов: 2СН4 → С2Н4 +2Н2 ↑ (реакция дегидрирования);
3) из природного газа и нефти.
Применение алкенов:
для производства горючего, пластмасс, взрывчатых веществ, антифризов, растворителей, для ускорения созревания фруктов.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|