
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Практическая работа. Цель: научиться решать задачи по теме. Примеры решения типовых задач. Ряд активности металлов, электродных потенциалов. Внимательно изучить тему.. Оформить практическую работу.. Решить задачи.
Практическая работа
Цель: научиться решать задачи по теме
Примеры решения типовых задач. Ряд активности металлов, электродных потенциалов
1. Внимательно изучить тему.
2. Оформить практическую работу.
3. Решить задачи.
Пример 1.Ряд активности металлов, электродных потенциалов.
Задача 1. Медная пластинка массой 10 г была погружена в раствор нитрата серебра, затем промыта водой и высушена. Масса ее оказалась равной 11,0 г. Сколько серебра из раствора выделилось на пластинке?
Решение. Для решения этой задачи необходимо знать стандартные электродные потенциалы металлов, т.е. место их в ряду напряжений (ряду активности металлов Бекетова).
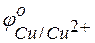 = +0.34 В;
= +0.34 В; 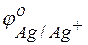 = +0.80 В.
= +0.80 В.
Из этих положительных потенциалов стандартный электродный потенциал меди менее положителен, следовательно, пойдёт реакция вытеснения:
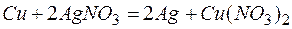
Для того чтобы вычислить количество серебра, выделившегося на медной пластинке, надо помнить, что медная пластинка в этой реакции и сама растворяется, теряя в массе.
Обозначим количество растворившейся меди через x г, тогда масса медной пластинки с учётом её растворения будет (10-х) г, масса выделившегося серебра на основе реакции:
64,0 г Cu – 2 ∙ 108 г Ag
х г Cu – (1+х) г Ag
216х =64+64х, 152x=64, x=0,42 г.
Таким образом, в течение реакции растворилось 0,42 г меди и выделилось 1,0 + 0,42 = 1,42 г серебра.
Пример 2.Работа гальванического элемента и расчёт ЭДС.
Задача 1. Напишите уравнения реакций, происходящих при работе гальванического элемента, состоящего из цинковой и серебряной пластин, опущенных в растворы своих солей с концентрацией катионов, равной 1 моль/л.
Решение. Стандартные электродные потенциалы цинкового и серебряного электродов соответственно равны:
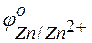 = –0,76 В;
= –0,76 В; 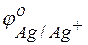 = +0,80 В.
= +0,80 В.
Металл, имеющий более отрицательное значение электродного потенциала при работе гальваничеcкого элемента, является анодом. В данном случае протекают реакции:
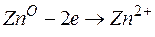
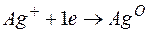
т.е. цинк, являясь анодом, растворяется при работе гальваничеcкого элемента, а серебро осаждается в виде металла на катоде. ЭДС гальванического элемента равна
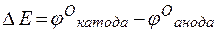 =
= 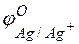 –
– 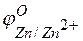 = +0,8 – (–0,76) =1,56 В.
= +0,8 – (–0,76) =1,56 В.
Пример 3. Зависимость электродных процессов от концентрации.
Задача 1. Рассчитайте, чему равна ЭДС элемента, составленного из медной и магниевой пластин, опущенных в растворы своих солей, если концентрация катиона у анода равна 0,1 моль/л, а у катода – 0,001 моль/л.
Решение. Стандартные электродные потенциалы магниевого и медного электродов соответственно равны:
 = –2,38 В;
= –2,38 В;  = +0.34 В.
= +0.34 В.
Следовательно, анодом будет магниевый электрод, катодом – медный. Электродный потенциал металла, опущенного в раствор с любой концентрацией катиона в растворе, определяют по формуле Нернста:
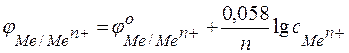 ,
,
где: с – концентрация катиона, моль/л;
п – число электронов, принимающих участие в реакции.
Отсюда потенциал магниевого электрода
 = –2,38 +
= –2,38 + 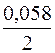 lg10–1 = –2,38 + 0,029(–1) = –2,409 В.
lg10–1 = –2,38 + 0,029(–1) = –2,409 В.
Потенциал медного электрода
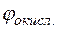 = +0,34 +
= +0,34 + 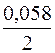 lg10–3 = +0,34 + 0,029(–3) = +0,253 В.
lg10–3 = +0,34 + 0,029(–3) = +0,253 В.
Тогда для гальванического элемента
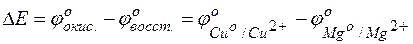 = +0,253–(–,409)=2,662В.
= +0,253–(–,409)=2,662В.
Пример 4. Определение возможности протекания реакции в гальвани-ческом элементе.
Задача 1. Исходя из величины стандартных электродных потенциалов и значения энергии Гиббса ΔGо298, укажите, можно ли в гальваническом элементе осуществить следующую реакцию:
Fe0 + Cd2+= Fe2+ + Cd0.
Решение. Надо составить схему гальванического элемента, отвечающего данной реакции. В этой реакции происходит восстановление ионов кадмия и окисление атомов железа:
Fe 0 – 2е = Fe 2+
Cd 2+ + 2е = Cd 0.
Пользуясь таблицей стандартных электродных потенциалов, определяем ЭДС этого гальваничекого элемента:
 = –0,40– (–0,44)=0,04 В.
= –0,40– (–0,44)=0,04 В.
Изменение величины энергии Гиббса с величиной ЭДС связано соотношением:
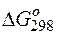 = – nF
= – nF 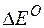 ,
,
где: 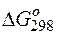 – изменение величины энергии Гиббса;
– изменение величины энергии Гиббса;
n – число электронов, принимающих участие в реакции;
F–число Фарадея;
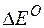 – ЭДС гальванического элемента.
– ЭДС гальванического элемента.
Находим 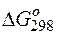 = –2∙96500∙0,04= – 7720 Дж.
= –2∙96500∙0,04= – 7720 Дж.
Так как 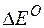 >0,
>0, 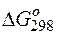 <0, следовательно, данную реакцию можно осуществить в гальваническом элементе. Реакция в прямом направлении идёт самопроизвольно.
<0, следовательно, данную реакцию можно осуществить в гальваническом элементе. Реакция в прямом направлении идёт самопроизвольно.
Пример 5.Расчет количества вещества, выделившегося при электролизе.
Задача 1. Какая масса меди осаждается на катоде при прохождении тока силой 2 А через раствор медного купороса в течение 15 минут?
Решение. Сначала нужно узнать количество электричества, прошедшее через раствор, выразив его в кулонах (1Кл=А.с). Количество электричества Q=I 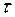 =2.15.60=1800 Кл. Молярная масса эквивалента меди (II) равна 64,0/2=32 г/моль. Следовательно:
=2.15.60=1800 Кл. Молярная масса эквивалента меди (II) равна 64,0/2=32 г/моль. Следовательно:
| 96500 Кл – 32 г |
| 1800 Кл – х г |
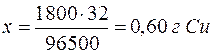
|
Пример 6.Определение электрохимического эквивалента и выхода по току.
Задача 1. При электролизе водного раствора AgNO3 в течение 50 минут при силе тока 3А выделилось 9,6 г серебра. Электролиз проводился с растворимым анодом. Напишите уравнение реакций катодного и анодного процессов и определите электрохимический эквивалент серебра в г/Кл и г/А.ч и выход по току.
Решение. Нитрат серебра диссоциирует:

Процессы, протекающие на электродах:
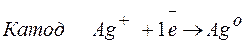
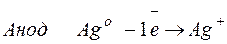
Молярная масса эквивалента AgО =108 г/моль.
Определяем массу серебра, которая выделилась бы теоретически при прохождении через раствор данного количества электричества:
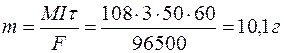
Выход по току
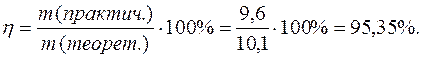
Электрохимический эквивалент
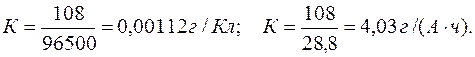
Задачи по теме «Ряд напряжений металлов»
1. К раствору, содержащему 41,5 г хлорида меди (II), прибавили 14 г железных стружек. Как изменится масса стружек после реакции?
2. Железную и цинковую пластины опустили в раствор сульфата меди (II). Через некоторое время суммарная масса пластин увеличилась на 0,3 г. Определите массу меди, которая выделилась на каждой пластине, если в растворе образовалось 23,7 г сульфата цинка и сульфата железа (II).
3. Железную сетку массой 10 г опустили в 200 г раствора сульфата меди (II) с массовой долей 20 %. Через некоторое время масса сетки увеличилась на 2 %. Определите концентрацию оставшегося в растворе сульфата меди (II).
4. Железную пластину опустили в раствор, содержащий смесь хлорида меди (II) и хлорида железа (II). После окончания реакции масса пластины возросла на 1,6 г. Определите массы солей в исходном растворе, если молярные количества солей были одинаковыми.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|