
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Практические задания дифференцированного зачета по химии
Практические задания дифференцированного зачета по химии
Неорганическая Химия
1. Назовите следующие элементы (русское название):
Н, С, Na, S, N, Mg, Сl, O, Al, Fr, F, K, Cu, P, Ca, Mn, Zn, Au, Ag, Br, Cu
2. Напишите схемы электронного строения, электронные и электронно-графические формулы атомов водорода, кислорода, серы, азота, фосфора, калия, натрия, лития, алюминия, фтора, хлора и углерода.
3. Пользуясь периодической системой, определите элементы, имеющие следующее строение валентного слоя: …3s2 3p5; …4s2 4p3; …5s1; …5s2 5p2; …4s23d10; …4s23d2.
4. Напишите формулы высших оксидов элементов с 1 по 8 группы
5. Электронная формула атома 1s 22s 22p 63s 23p2 . Какой химический знак этого элемента
6. Как изменяются радиусы атомов химических элементов в ряду: хлор, фосфор, алюминий, натрий (увеличиваются, уменьшаются, не изменяются).
7. Какая химическая связь в молекуле воды
8. Формулы кислотных оксидов: 1) CO2 и CaO; 2) CO2 и SO3; 3) K2O и Al2O3
9. Формула сероводородной кислоты: 1) H2S; 2) H2SO4; 3) H2SO3
10. К реакциям обмена относится:
1) CaO + H2O à Ca(OH)2; 2) Сu(OH)2 à CuO + H2O; 3) KOH + HNO3 à KNO3 + H2O
11. Электролиты, при диссоциации которых образуются катионы металла, и анионы кислотного остатка называются: 1) кислотами; 2) солями; 3) основаниями.
12. Чему равен коэффициент перед формулой восстановителя в уравнении реакции алюминия с кислородом
13. Число нейтронов, которые содержатся в атоме кислорода
14. Формула высшего оксида элемента, электронная формула которого 1s22s22p63s23p3
1) N2 O5 2) P2 O5 3) B2O3
15. Наиболее ярко выраженные неметаллические свойства проявляет:
1) фосфор; 2) сера; 3) кремний.
16. Формула основания и кислоты соответственно:
1) Ca(OH)2 и Be(OH)2 ; 2) NaOH и KHSO4; 3) Al(OH)3 и HNO3
17. Формула сульфита натрия: 1) Na2SO4; 2) Na2SO3; 3) Na2S
18. К реакциям замещения относится: 1) Ca + H2SO4 à CaSO4 + H2;
2) Сu(OH)2 à CuO + H2O; 3) KOH + HNO3 à KNO3 + H2O
19. Электролиты, при диссоциации которых образуются катионы металла и гидроксид-ионы называются: 1) солями; 2) кислотами; 3) основаниями.
20. Коэффициент перед формулой окислителя в уравнении реакции алюминия с серой (II) равен: 1) 8; 2) 2; 3) 3.
21. Число протонов, которые содержатся в атоме азота
22. Электронная формула внешнего энергетического уровня атома углерода
23. Наиболее ярко выраженные металлические свойства проявляет:
1) магний; 2) кальций; 3) барий.
24. Химическая связь в молекуле кислорода:
1) ионная; 2) ковалентная полярная; 3) ковалентная неполярная.
25. Формулы основных оксидов:
1) CO2 и SO3; 2) K2O и CaO; 3) CO2 и Al2O3.
26. Формула гидроксида железа (III):
1) Fe(OH)2; 2) Fe(OH)3; 3) Fe2O3.
27. К реакциям соединения относится:
1) KOH + HNO3 à KNO3 + H2O;
2) Сu(OH)2 à CuO + H2O; 3) CaO + H2O à Ca(OH)2
28. При диссоциации вещества в водном растворе образовались ионы K + , H+ и CO32- . Это вещество является: 1) кислой солью; 2) средней солью; 3) щелочью.
29. Определить число протонов, нейтронов и электронов и заряд ядра атома для следующих элементов: Na, CI, Са, Al, S, P, C, K, O, N
30. Сумма коэффициентов в уравнении реакции алюминия с серной кислотой.
31. Химическому элементу 2-го периода VIA-группы соответствует схема распределения электронов 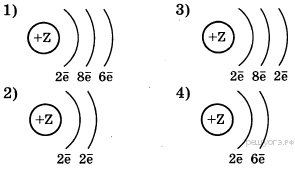
32. В каком ряду химических элементов усиливаются металлические свойства соответствующих им простых веществ?
1) калий → натрий → литий
2) сурьма → мышьяк → фосфор
3) углерод → кремний → германий
4) алюминий → кремний → углерод
33. Неметаллические свойства фосфора выражены сильнее, чем неметаллические свойства
1) азота
2) кислорода
3) серы
4) кремния
34. Сложное вещество
А) водород В) кислород
С) сера D) аммиак Е) фосфор
35.Тип реакции АВ=А+В
А) разложения В) соединения
С) обмена D) замещения
Е) гидрирования
36. Основной оксид
А) CaO В) Al2O3 С) CO2 D) P2O3
Е) N2O5
37. Формула одноосновной бескислородной кислоты
А) H2SO3 В) HCl С) H3PO4 D) H2SO4 Е) H2S
38. Относительная молекулярная масса сульфата калия
39. Ряд чисел 2,8,7 соответствуют распределению электронов по энергетическим уровням атома
А) Al В) N С) P D) Cl Е) S
40. Число нейтронов в ядре атома свинца 207Pb
А) 82 В) 125 С) 207 D) 289 Е) 307
41. Наиболее выражены металлические свойства
А) Si В) C С) Ge D) Sn Е) Pb
42.Число энергетических уровней в атоме определяется по
А) порядковому номеру элемента
В) номеру группы С) номеру периода
D) номеру ряда Е) атомной массе
43. Ковалентная полярная связь в молекуле
А) NaCl В) Cl2 С) CaCl2 D) NH3 Е) P4
44. В реакции SO2 + O2= SO3 коэффициент перед окислителем
А) 1 В) 2 С) 3 D) 4 Е) 5
45. Распределите вещества по классам неорганических соединений:
А) кислоты Б) основания В) соли Г) оксиды и дайте им названия:
Cu2O, KNO3, Na2Si03, Н3РО4, A12(S04)3, H2SO4 , K2S, Mg(OH)2 , SO3, CaCO3, H2SO3, NH4OH, PO3, Zn(OH)2, H2SiO3, AlCl3 , CO2 , H2S ,NaOH , K2O , Fe(OH)3 , H2CO3 , N2O3 , Cu(OH)2
46. Неправильно определена степень окисления азота в соединении
А) N2+1O В) N2+5O5 С) N+2O D) N+3H3 Е) N2+3O3
47. Формула высшего оксида элемента, находящегося в 3 периоде, V группе, главной подгруппе
А) As2O5 В) Nb2O5 С) P2O5 D) V2O5 Е) N2O5
48. Металлы расположены в порядке возрастания металлических свойств в ряду
А) K, Na, Li В) Ca, Sr, Ba С) Na, Mg, Al
D) Cs, Rb, K Е) Ba, Mg, Be
49. Коэффициент перед калием в уравнении реакции: К + S = K2S
А) 1 В) 2 С) 3 D) 4 Е) 5
50.Простое вещество
А) вода В) кислород
С) сероводород D) аммиак Е) фосфин
51. Тип реакции А+В=С
А) разложения В) соединения
С) обмена D) замещения Е) дегидрирования
52. Амфотерный оксид
А) FeO В) Al2O3 С) MgO
D) P2O3 Е) N2O5
53. Формула кислоты
А) NаОН В) HCl С) K2O
D) NaHSO4 Е) Fe(OH)2
54. Относительная молекулярная масса карбоната натрия
55. Массовая доля натрия в гидроксиде натрия
А) 50% В) 28,5% С) 42,5% D) 34% Е) 57,5%
56. Ряд чисел 2,8,5 соответствуют распределению
электронов по энергетическим уровням атома
А) Al В) N С) P D) Cl Е) S
57. Число протонов в ядре атома серы S
58. Наиболее выражены неметаллические свойства
А) Si В) C С) Ge D) Sn Е) Pb
59.Число электронов в атоме определяется по
А) порядковому номеру элемента
В) номеру группы С) номеру периода
D) номеру ряда Е) атомной массе
60. Ковалентная неполярная связь в молекуле
А) NaCl В) Cl2 С) CaCl2 D) NH3
Е) P2О5
61. Неметалл
А) Ba В) Cu С) Mg D) Mn Е) Cl
62. Металлы расположены в порядке убывания металлических свойств в ряду
А) K, Na, Li В) Ca, Sr, Ba
С) Al, Mg, Na D) Al, Ga, In
Е) Be, Mg, Ba
63. Валентность азота в NO2, N2O, N2O3 соответственно
А) IV, I, III В) II, IV, VI С) II, III, VI
D) IV, II, II Е) II, VI, III
64. Тип реакции: Ca + 2H2O = Ca(OH)2 + H2
А) разложения В) соединения С) обмена
D) замещения Е) дегидрирования
65. Кислотный, амфотерный, основной оксиды соответственно в группе
А) FeO, Al2O3, SO3 В) Al2O3, SO3, CaO
С) SO3, Al2O3, CaO D) CaO, Al2O3, SO3
Е) SO3, CaO, Al2O3
66. Электронная формула атома азота
А) 1s22s22p3 В) 1s22s2 2p63s2
С) 1s22s22p63s23p1 D) 1s22s22p2
Е) 1s22s22p63s23p2
67. Формула трёхосновной кислородсодержащей кислоты
А) HNO3 В) HCl С) H3PO4
D) H2SO4 Е) H2S
68. Формула средней соли
А) NaHCO3 В) KCl С) NaH2PO4
D) CuOHCl Е) LiHS
69. Ряд чисел 2,8,1 соответствуют распределению электронов по энергетическим уровням атома
А) Na В) Mg С) P D) Cl Е) Si
70. Число электронов на внешнем энергетическом уровне атома хлора
А) 1 В) 2 С) 3 D) 7 Е) 6
71.Число протонов в атоме определяется по
А) порядковому номеру элемента
В) номеру группы С) номеру периода
D) номеру ряда Е) атомной массе
72. Ионная связь в молекуле
А) НCl В) Cl2 С) CaCl2 D) NH3 Е) P2О5
73. Степень окисления серы в сульфиде калия K2S
А) +1 В) +2 С) -2 D) +4 Е) -4
74. Не электролит
А) NaCl В) K2CO3 С) HNO3 D) C6H12O6
Е) Na2CO3
75. Неметаллу соответствует электронная формула
А) 1s22s22p63s1 В) 1s22s22p63s2 С) 1s22s22p63s23p1
D) 1s22s22p63s23p3 Е) 1s22s2
76. Массовая доля серы в оксиде серы (IV)
А) 50% В) 25% С) 40% D) 80% Е) 65%
77. Только металлы расположены в ряду
А) N, Na, Li В) Ca, Sr, Ba С) As, Mg, P
D) Cl, Br, I Е) Be, H, B
78. Наименьший радиус атома
А) Na В) K С) Cs D) Li Е) Fr
79.Тип реакции: CaO + 2HCl = CaCl2 + H2O
А) разложения В) соединения
С) обмена D) замещения Е) дегидрирования
80. Кислотный оксид
А) FeO В) Al2O3 С) SO3 D) CaO Е) Na2O
81. Ионная связь в молекулах всех веществ группы
А) НCl, Cl2, CaCl2 В) Cl2, NH3, P2О5
С) CaCl2, NaBr, KF D) NH3, SiO2, NaBr
Е) P2О5, N2, KF
82.Формула двухосновной бескислородной кислоты
А) H2SO3 В) HCl С) H3PO4 D) H2SO4 Е) H2S
83. Относительная молекулярная масса нитрата магния
А) 148 В) 112 С) 90 D) 174 Е) 106
84.Ряд чисел 2,8,3 соответствуют распределению электронов по энергетическим уровням атома
А)Al В)N С)P D)Cl Е)S
85. Ковалентная полярная связь в молекулах веществ группы
А) НCl, Cl2 В) Cl2, NH3 С) CaCl2, NaBr
D) NH3, СO2 Е) P2О5, N2
86. Степень окисления серы в сульфате калия K2SO4
А) +3 В) +2 С) -2 D) +4 Е) +6
87. Электронная формула 1s22s22p63s23p5 соответствует неметаллу
88. Относительная молекулярная масса сероводорода
А) 32 В) 31 С) 34 D) 64 Е) 68
89. Сумма коэффициентов в уравнении реакции горения фосфора
90. Только металлы побочных подгрупп расположены в ряду
А) Mn, Na, Li В) Ca, Ag, Ba
С) Al, Mg, Pb D) Fe, Mn, V
Е) Be, Hg, Fe
91. Число электронов в ионе Na+
92. Число нейтронов в ядре атома определяется по формуле
А) N=Z-Ar В) N= Ar- Z С) N=NA∙ υ
D) Е) N=n
93. Только металлы главных подгрупп расположены в ряду
А) Mn, Na, Li В) Ca, Ag, Ba С) Al, Mg, Pb
D) Cs, Ba, V Е) Be, Hg, Fe
94. Наибольший радиус атома
А) Na В) K С) Cs D) Li Е) Fr
95. Валентность серы в SO2, H2S, Al2S3 соответственно
А) VI, II, III В) II, IV, VI
С) II, III, VI D) IV, II, II Е) II, VI, III
96. Ряд чисел 2,8,2 соответствуют распределению электронов по энергетическим уровням атома
97. Число нейтронов в ядре атома брома 80Br
98. Используя таблицу Д.И. Менделеева, найдите валентность атомов элементов: B, H, Na, Cs, Al, F, Be, O, Rb
99. Определите валентность атомов элементов в бинарных соединениях:
HBr, Mn2O7, SiO2, PbO, N2O5, Cs2O, NaCl, Al2O3, BeO, HI
100. Определите валентность атомов элементов, в соединениях состоящих из трех и более элементов: MgSO4, HNO2, H2SiO3, Na2SO4, KClO3
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|