
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Он поможет вам лучше понять материал. На следующей паре будем решать самостоятельно задачи по этой теме.
20.05.20
1. Посмотрите обязательно ролик "Произведение растворимости":
https://www.youtube.com/watch?time_continue=44&v=5Uxg_grRKVs&feature=emb_logo
Он поможет вам лучше понять материал. На следующей паре будем решать самостоятельно задачи по этой теме.
2. Запишите конспект в рабочую тетрадь.
3. Отправьте выполненное задание в комментарии к уроку. Можно даже опоздать, но понять.
Фамилия Имя обучающегося
Тема. Произведение растворимости, условия образования осадков
Абсолютно нерастворимых веществ нет. Большинство твердых веществ обладают ограниченной растворимостью. В насыщенных растворах электролитов малорастворимых веществ в состоянии динамического равновесия находятся осадок и насыщенный раствор электролита. Например, в насыщенном растворе сульфата бария, находящегося в контакте с кристаллами этого вещества, устанавливается динамическое равновесие:
BaSO4 (т) = Ba2+(р) + SO42-(р)
Для этого равновесного процесса можно написать выражение константы равновесия, учитывая, что концентрация твердой фазы не входит в выражение константы равновесия:
Kp = [Ba2+] [SO42-]
Эта величина называется произведением растворимости (ПР) малорастворимого вещества. Таким образом, в насыщенном растворе малорастворимого соединения произведение концентраций его ионов в степени стехиометрических коэффициентов равно величине произведения растворимости. В рассмотренном примере: ПРBaSO4 = [Ba2+] [SO42-]
В тех случаях, когда электролит содержит два или несколько одинаковых ионов, концентрации этих ионов при вычислении произведения растворимости должны быть возведены в соответствующие степени.
Например, для сульфида меди (I) Cu2S, уравнение диссоциации которого имеет вид: Cu2S = 2Cu+ + S2-. Произведение растворимости вычисляется по формуле:
ПP Cu2S = [Cu+ ]2 · [S2-]
Произведение растворимости характеризует растворимость малорастворимого вещества при данной температуре: чем меньше произведение растворимости, тем хуже растворимо соединение.
Величина ПР характеризует сравнительную растворимость однотипных (образующих при диссоциации одинаковое количество ионов) веществ. Чем больше ПР данного вещества, тем больше его растворимость. Например:
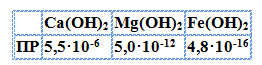
В данном случае наименее растворимым является гидроксид железа (II).
Поскольку произведение растворимости обычно очень малая величина, то часто вместо числового значения ПР приводят его показатель. Показатель растворимости (рПР):
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|