
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема : « Решение задач на химическое равновесие».
Тема : « Решение задач на химическое равновесие».
Внимательно изучите алгоритм и запишите в тетрадь.
Пример 1. Во сколько раз изменится скорость прямой и обратной реакции в системе: 2SO2(г) + O2(г) = 2SO3(г) если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы?
Решение. Обозначим концентрации реагирующих веществ: [SO2]= a, [О2] = b, [SO3] = с.Согласно закону действия масс скорости v прямой и обратной реакции до изменения объема:
vпр = Ка2b vобр = К1с2.
После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [SO2] = 3а, [О2] = 3b; [SO3] = 3с. При новых концентрациях скорости v’ прямой и обратной реакции:
v’пр = К(3а)2(3b) = 27Ка2b
v’обр = К1(3с)2 = 9К1с2
Отсюда:
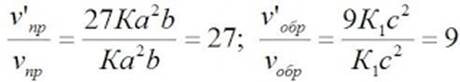
Следовательно, скорость прямой реакции увеличилась в 27 раз, а обратной – только в девять раз. Равновесие системы сместилось в сторону образования SO3.
Пример 2 Константа равновесия гомогенной системы:
СО(г) + Н2О(г) = СО2(г) + Н2(г)
при 850оС равна 1. Вычислите концентрации всех веществ при равновесии, если исходные концентрации: [СО]исх =3 моль/л, [Н2О]исх = 2 моль/л.
Решение. При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
vпр = К1 [СО][Н2О] vобр = К2[СО2][Н2]

условии задачи даны исходные концентрации, тогда как в выражение Кр входят только равновесные концентрации всех веществ системы. Предположим, что к моменту равновесия концентрации [СО2]р = х моль/л. Согласно уравнению системы число молей образовавшегося водорода при этом будет также х моль/л. По столько же молей (х моль/л) СО и Н2О расходуется для образования по х молей СО2 и Н2. Следовательно, равновесные концентрации всех четырех веществ:
[СО2]р = [Н2]р = х моль/л; [СО]р = (3 – х) моль/л; [Н2О]р = (2 – х) моль/л.
Зная константу равновесия, находим значение х, а затем исходные концентрации всех веществ:

Таким образом, искомые равновесные концентрации:
[СО2]р = 1,2 моль/л; [Н2]р= 1,2 моль/л;
[СО]р = 3 – 1,2 = 1,8 моль/л; [Н2О]р = 2 – 1,2 = 0,8 моль/л.
Решите самостоятельно следующие задачи:
1. Реакция соединения азота и водорода обратима и протекает по уравнению
N2 + 3Н2 2NН3. При состоянии равновесия концентрации участвующих в ней веществ были: [N2] = 0,01 моль/л, [Н2] = 2,0 моль/л, [NH3] = 0,40 моль/л. Вычислить константу равновесия и исходные концентрации азота и водорода.
2. Реакция протекает по уравнению 2H2+O2«2H2O. В каком направлении сместится химическое равновесие, если давление увеличить в 4 раза?
Ответ подтвердите расчетами.
3. Дана реакция: 2NO + Cl2 ⇄ 2NOCl . Вычислите константу равновесия, если равновесные концентрации веществ для данной реакции: c(NO) = 1.8 моль/л , c(Cl2) = 1.2 моль/л , c(NOCl) = 0.8 моль/л.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|