
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Тема. Окислительные и восстановительные свойства неметаллов.
Тема. Окислительные и восстановительные свойства неметаллов.
1 .Окислительные и восстановительные свойства неметаллов в зависимости от их положения в ряду электроотрицательности.
Исходя из положения неметаллов в периодической системе Менделеева, можно выявить свойства для них характерные. Можно определить количество электронов на внешнем энергетическом подуровне, местоположение неметаллов в конце малых и больших периодов, число электронов на внешнем подуровне соответствует номеру группы. В периоде идет возрастание способности присоединять электроны, а в группе это свойство можно наблюдать по мере уменьшения радиуса (в периоде снизу вверх).
Для неметаллов характерно свойство присоединять электроны, проявлять окислительные свойства. Наиболее они выражены у элементов VI и VII групп. Самый сильный окислитель – фтор.
Окислительные свойства неметаллов возрастают в последовательности:
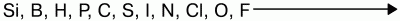
Фтор никогда не проявляет восстановительных свойств. Другие неметаллы и вещества, им соответствующие, могут проявлять восстановительные свойства, но они слабее, чем у металлов.
Восстановительная способность неметаллов увеличивается от кислорода к кремнию в ряду:

Так, хлор напрямую не взаимодействует с кислородом, но можно получить оксиды хлора (Cl2O, ClO2, Cl2O7), в которых хлор проявляет положительную степень окисления. Азот при высоких температурах вступает в реакцию с кислородом, выказывая восстановительные свойства:
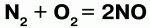
Сера проявляет как окислительные, так и восстановительные свойства:
S + O2 = SO2 – окислительные свойства серы;
S + H2 = H2S – восстановительные свойства серы.
Примеры окислительно-восстановительных реакций:
· восстановительные свойства – образование оксидов и фторидов неметаллов;
· окислительные свойства неметаллов – образование галогенидов, сульфидов, карбидов, нитридов, фосфидов.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|