
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
I. Основные свойства
Урок. Химические свойства аминов: взаимодействие с кислотами и водой. Основность аминов.
Д/з мне присылают: Глущенко, Залевский, Заикина, Нтконова, Кобзарев, Балашвили, Табаева, Дербенева
Записать все химические свойства аминов, ряд увеличения основности.
I. Основные свойства
Для аминов характерны основные свойства, которые обусловлены наличием не поделённой электронной пары на атоме азота
1. Взаимодействие с кислотами (донорно-акцепторный механизм):
CH3-NH2 + H2SO4 → [CH3-NH3]HSO4
(соль - гидросульфат метиламмония)
2CH3-NH2 + H2SO4 → [CH3-NH3]2SO4
(соль - сульфат метиламмония)
CH3-NH2 + НСI → [CH3-NH3]CI - хлоридметиламмоний
2. Водные растворы аминов имеют щелочную реакцию (амины реагируют с водой по донорно-акцепторному механизму):
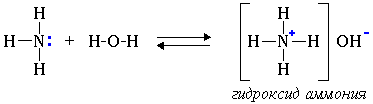
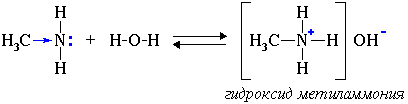
СН3-NH2 + H2O → [СН3-NH3]+ + OH-
ион алкиламмония
Ряд увеличения основных свойств аминов:
| C6H5-NH2 < NH3 < R3N < R-NH2 < R2NH -------------------------------------------------→ возрастание основных свойств |
В растворах оснoвные свойства третичных аминов проявляются слабее, чем у вторичных и даже первичных аминов, так как три радикала создают пространственные препятствия для сольватации образующихся аммониевых ионов. По этой же причине основность первичных и вторичных аминов снижается с увеличением размеров и разветвленности радикалов.
Соли неустойчивы, разлагаются щелочами:
[CH3-NH3]2SO4 + 2NaOH → 2CH3-NH2 ↑ + Na2SO4 + H2O
Способность к образованию растворимых солей с последующим их разложением под действием оснований часто используют для выделения и очистки аминов, не растворимых в воде. Например, анилин, который практически не растворяется в воде, можно растворить в соляной кислоте и отделить нерастворимые примеси, а затем, добавив раствор щелочи (нейтрализация водного раствора), выделить анилин в свободном состоянии.

3. Реакции окисления
Реакция горения (полного окисления) аминов на примере метиламина:
4СH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
Ароматические амины легко окисляются даже кислородом воздуха. Являясь в чистом виде бесцветными веществами, на воздухе они темнеют. Неполное окисление ароматических аминов используется в производстве красителей. Эти реакции обычно очень сложны.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|