
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Окислительные свойства соединений железа(III)
97 Соединения марганца(VII), оксид, марганцевая кислота, перманганаты, получение, химические свойства. Перманганат калия, его окислительные свойства в кислой и щелочной средах, применение. Пиролиз перманганата калия.
Оксид марганца (VII) Mn2O7 – маслянистая жидкость черно-зеленого цвета, выше 50°С разлагается с образованием кислорода и низших оксидов, при более высокой температуре взрывается:
2Mn2O7 = 4MnO2 + 3O2.
Проявляет кислотные свойства. Реагирует с водой, образуя марганцовую кислоту:
Mn2O7 + H2O = 2HMnO4.
Оксид марганца можно получить только косвенным путем:
2KMnO4 + H2SO4 = Mn2O7 + K2SO4 + H2O.
Марганцовая кислота – сильная кислота, очень неустойчивая, разлагается уже выше 3°С:
4HMnO4 = 4MnO2 + 2H2O + 3O2.
Марганцовая кислота, как и её соли (перманганаты), является очень сильным окислителем, например в реакциях:
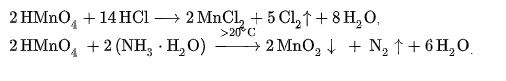
Проявляет общие для сильных кислот свойства, например вступает в реакции нейтрализации с сильными и слабыми основаниями:
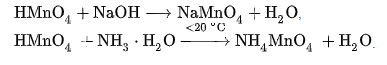
Соли марганцевой кислоты – перманганаты – содержат в составе перманганат-ион MnO4-, в растворе – фиолетового цвета. Проявляют окислительные свойства, в кислой среде образуются соединения марганца (II):
2KMnO4 + 5K2SO3 + 3H2SO4 = 2MnSO4 + 6K2SO4 + 3H2O
в нейтральной – марганца (IV):
2KMnO4 + 3K2SO3 + H2O = 2MnO2 + 3K2SO4 + 2KOH
в щелочной – марганца (VI):
2KMnO4 + K2SO3 + 2KOH = 2K2MnO4 + K2SO4 + H2O
При нагревании разлагаются (Пиролиз перманганата калия):
2KMnO4 = K2MnO4 + MnO2 + O2.
Перманганат калия получается по следующей схеме:
2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O;
затем манганат переводится в перманганат электрохимическим окислением, суммарное уравнение процесса имеет вид:
2K2MnO4 + 2H2O = 2KMnO4 + 2KOH + Н2.
98 Железо, кобальт, никель. Отношение к кислотам, щелочам, различным окислителям. Железо(II, III), кобальт(II, III), никель(II, III), их оксиды, гидроксиды.
В химическом отношении железо, кобальт и никель относятся к металлам средней активности. В электрохимическом ряду напряжений металлов они располагаются левее водорода, между цинком и оловом. Чистые металлы при комнатной температуре довольно устойчивы, их активность сильно увеличивается при нагревании, особенно если они находятся в мелкодисперсном состоянии. Наличие примесей значительно снижает устойчивость металлов.
1. Взаимодействие с неметаллами
При нагревании на воздухе выше 200 °С железо взаимодействует с кислородом, образуя оксиды нестехиометрического состава FexO, мелкодисперсное железо сгорает с образованием смешанного оксида железа (II, III):
3Fe + 2O2 = Fe3O4.
Кобальт и никель реагируют с кислородом при более высоких температурах, образуя в основном оксиды двухвалентных элементов, имеющие переменный состав в зависимости от условий получения:
2Co + O2 = 2CoO,
2Ni + O2 = 2NiO.
С галогенами металлы реагируют, образуя галогениды :
2Fe + 3Cl2 = 2FeCl3,
Co + Br2 = CoBr2,
Ni + Cl2 = NiCl2.
Металлы довольно устойчивы к действию фтора, никель не разрушается фтором даже при температуре красного каления.
При взаимодействии с азотом при невысокой температуре железо, кобальт и никель образуют нитриды различного состава, например:
4Fe + N2 = 2Fe2N,
2Co + N2 = 2CoN,
3Ni + N2 = Ni3N2.
Взаимодействие с серой экзотермично и начинается при слабом нагревании, в результате образуются нестехиометрические соединения, которые имеют состав, близкий к ЭS:
Э + S = ЭS.
С водородом металлы триады железа не образуют стехиометрических соединений, но они поглощают водород в значительных количествах.
С углеродом, бором, кремнием, фосфором также при нагревании образуют соединения нестехиометрического состава, например:
3Co + C = Co3C,
2Ni + B = Ni2B,
Co + Si = CoSi,
3Fe + P = Fe3P.
2. Взаимодействие с водой
В воде в присутствии кислорода железо медленно окисляется кислородом воздуха (корродирует):
4Fe + 3O2 + 6H2O = 4Fe(OH)3.
При температуре 700–900 °С раскаленное железо реагирует с водяным паром:
3Fe + 4H2O = Fe3O4 + 4H2.
Кобальт и никель с водой не взаимодействуют.
3. Взаимодействие с кислотами
Железо реагирует с разбавленными растворами соляной и серной кислот, образуя соли железа (II):
Fe + 2HCl = FeCl2 + H2,
Fe + H2SO4 = FeSO4 + H2;
с разбавленной азотной кислотой образует нитрат железа (III) и продукт восстановления азотной кислоты, состав которого зависит от концентрации кислоты, например:
Fe + 4HNO3 = Fe(NO3)3 + NO + 2H2O.
При обычных условиях концентрированные (до 70 мас. %) серная и азотная кислоты пассивируют железо. При нагревании возможно взаимодействие с образованием солей железа (III):
2Fe + 6H2SO4 = Fe2(SO4)3 + 3SO2 + 6H2O,
Fe + 6HNO3 = Fe(NO3)3 + 3NO2 + 3H2O.
По отношению к кислотам кобальт и никель устойчивее железа, медленно реагируют с неокисляющими кислотами с образованием солей кобальта (II) и никеля (II) и водорода. С разбавленной азотной кислотой образуют нитраты кобальта (II) и никеля (II) и продукт восстановления азотной кислоты, состав которого зависит от концентрации кислоты:
3Э + 8HNO3 = 3Э(NO3)2 + 2NO + 4H2O.
При обычных условиях концентрированные серная и азотная кислоты пассивируют кобальт и никель, хотя в меньшей степени, чем железо. При нагревании возможно взаимодействие с образованием солей железа двухвалентных металлов:
Co + 2H2SO4 = CoSO4 + SO2 + 2H2O,
Ni + 4HNO3 = Ni(NO3)2 + 2NO2 + 2H2O.
4. Взаимодействие со щелочами
Разбавленные растворы щелочей на металлы триады железа не действуют. Возможно только взаимодействие железа с щелочными расплавами сильных окислителей:
Fe + KClO3 + 2KOH = K2FeO4 + KCl + H2O.
Для кобальта и никеля взаимодействие с расплавами щелочей не характерно.
5. Восстановительные свойства
Железо, кобальт и никель вытесняют металлы, которые расположены правее в электрохимическом ряду напряжений их растворов солей:
Fe + SnCl2 = FeCl2 + Sn,
Ni + CuSO4 = NiSO4 + Cu.
6. Образование карбонилов
Для металлов триады железа характерно образование карбонилов, в которых железо, кобальт и никель имеют степень окисления, равную 0. Карбонилы железа и никеля получаются при обычном давлении и температуре 20–60 °С:
Fe + 5CO = Fe(CO)5,
Ni + 4CO = Ni(CO)4.
Карбонилы никеля образуются при давлении 2·107 – 3·107 Па и температуре 150–200 °С:
2Co + 8CO = Co2(CO)8.


99 Условие устойчивости соединений кобальта(II) и (III) в водных растворах. Окислительные свойства соединений железа(III), восстановительные свойства соединений железа(II).
Окислительные свойства соединений железа(III)
Проявляет окислительные и восстановительные свойства. При нагревании восстанавливается водородом или оксидом углерода (II), проявляя окислительные свойства:
Fe2O3 + H2 = 2FeO + H2O,
Fe2O3 + CO = 2FeO + CO2.
Например, оксид железа (III) реагирует с угарным газом при нагревании. При этом возможно восстановление как до чистого железа, так и до оксида железа (II):
Fe2O3+3CO=2Fe+3CO2
Также оксид железа (III) восстанавливается водородом:
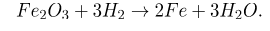
Оксид железа (II, III) реагирует с более активными металлами.
Например, с алюминием (алюмотермия):
Fe2O3 + 2 Al → 2Fe + Al2O3
Соединения железа (III) - слабые окислители, реагируют с сильными восстановителями
2Fe+3Cl3 + H2S-2 = S0↓ + 2Fe+2Cl2 + 2HCl
FeCl3 + KI = I2↓ + FeCl2 + KCl
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|