
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
мая 2020 г. (пятница) . Степень электролитической диссоциации
22 мая 2020 г. (пятница)
Дисциплина: Химия
Группа: № 74
Урок № 37
Литература: Рудзитис Г. Е. Химия. 11 класс: учеб. для общеобразоват. организаций с прил. на электрон. носителе базовый уровень / Г. Е. Рудзитис, Ф. Г. Фельдман. – М.: Просвещение, 2014. – 224 с.
Видеоурок https://www.youtube.com/watch?v=blZTK8qaQnM
Тема: Степень диссоциации электролита.
Цели урока:сформировать знания о степени диссоциации и силе электролитов.
Задачи:
Обучающие: углубить понятия об электролитах и ЭД;
показать влияние разбавления, температуры на степень диссоциации;
определить понятие «степень электролитической диссоциации», сильные и слабые электролиты.
Развивающие: научиться определять силу электролита в зависимости от степени диссоциации;
развивать умение на основе теоретических знаний сравнивать, анализировать, обобщать.
Воспитательные: прививать интерес к предмету.
Степень электролитической диссоциации
Поскольку электролитическая диссоциация - процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Другими словами, различные электролиты, согласно теории С. Аррениуса, диссоциируют на ионы в различной степени. Полнота распада (сила электролита) характеризуется количественной величиной – степенью диссоциации.
Степень диссоциации(α –греческая буква альфа) - это отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N):
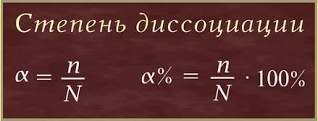
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|