
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Параграф 3. Строение атома. Дискретность энергетических состояний атома. Постулаты Бора
Параграф 3. Строение атома. Дискретность энергетических состояний атома. Постулаты Бора
В 1911 году Резерфорд предложил ядерную модель строения атома. Он также сделал предположение о превращении эл-тов вокруг ядра, т.к атом в виде статистической системы не может быть устойчивым.
То что в центре атома находится сравнительно массивное ядро Резерфорд доказал в опытах с рассеянием альфа частот, проходящих через в-во.
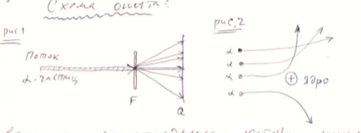 Поток альфа частиц испускаемых радиоактивным веществом двигались в вакууме и проходя через фольгу F падали на люминисцирующий экран Q. Удар кадой часицвы вызвал вспышку-сцинтиляцию, которую можно было наблюдать в микроскоп. Большинство альфа частиц проходят сквозь фольгу без заметного отклонения от первоначального направления.Некоторые частицы отклоняются на небольшой угол и лишь немногие альфа частицы испытывают сильное отклонение.
Поток альфа частиц испускаемых радиоактивным веществом двигались в вакууме и проходя через фольгу F падали на люминисцирующий экран Q. Удар кадой часицвы вызвал вспышку-сцинтиляцию, которую можно было наблюдать в микроскоп. Большинство альфа частиц проходят сквозь фольгу без заметного отклонения от первоначального направления.Некоторые частицы отклоняются на небольшой угол и лишь немногие альфа частицы испытывают сильное отклонение.
Полагая, что ядро и альфа частица взаимодействует, Резерфорд теоретически рассчитал картину рассеивания альфа частиц. Исследования резерфорда позволили определить размер ядра и и величину его заряда. Оказалось, что заряд q ядра выраженный в элементарных зарядах e равен порядковому номеру Z хим элемента в периодической системе Менделеева:
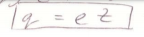 Однако резерфордовская модель строения атома не укладывалась в рамки законов классической физики. Ведь по законам классической электродинамики, электрон, вращаясь вокруг ядра, должен непрерывно излучать электромагнитные волны.Т.к при таком излучении непрерывно теряется энергия, и электрон должен постепенно приближаться к ядру по спирали и в конце концов упасть на ядро. Значит атом должен иметь сплошной спектр излучения. В действительности атомы- это весьма устойчивые образования обладающие линейным спектром излучения. Тщательные исследования спектров изл-я показали, что каждому ряду частиц подходит определенный линейчатый спектр. Также обнаружилось, что спектральные линии можно распределить по группам. Линии принадл к одной серии связаны между собой опр зак-тью.Бельмар обнаружил серию линий, частота которых выражается эмпирической ф-лой.
Однако резерфордовская модель строения атома не укладывалась в рамки законов классической физики. Ведь по законам классической электродинамики, электрон, вращаясь вокруг ядра, должен непрерывно излучать электромагнитные волны.Т.к при таком излучении непрерывно теряется энергия, и электрон должен постепенно приближаться к ядру по спирали и в конце концов упасть на ядро. Значит атом должен иметь сплошной спектр излучения. В действительности атомы- это весьма устойчивые образования обладающие линейным спектром излучения. Тщательные исследования спектров изл-я показали, что каждому ряду частиц подходит определенный линейчатый спектр. Также обнаружилось, что спектральные линии можно распределить по группам. Линии принадл к одной серии связаны между собой опр зак-тью.Бельмар обнаружил серию линий, частота которых выражается эмпирической ф-лой.
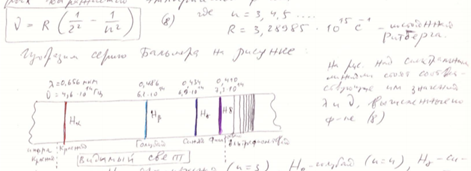
 Линейчатый х-р спектров излучений атомов говорил о том, что атом может излучать и поглощать энергию не в любых количествах отл др от друга, а только вполне определенными порциями-квантами. Отсюда следует, что атом может находиться лишь в определенных энергетических системах. Атом переходя из одного состояния в другое, излучает квант энергии, равный разности энергий начального и конечного состояний.
Линейчатый х-р спектров излучений атомов говорил о том, что атом может излучать и поглощать энергию не в любых количествах отл др от друга, а только вполне определенными порциями-квантами. Отсюда следует, что атом может находиться лишь в определенных энергетических системах. Атом переходя из одного состояния в другое, излучает квант энергии, равный разности энергий начального и конечного состояний.
Три постулата Бора:
1.Электроны могут двигаться в атоме непо любым орбитам, а только по орбитам вполне определенного радиуса.
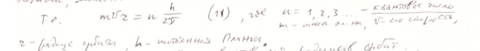 -условие квантований радиусов орбит.
-условие квантований радиусов орбит.
2.Движение электронов по стационарным орбитам не сопровождается излучением(поглощением) энергии.
3. Переход электрона с одной стационарной орбиты на другую сопровождается излучением(поглощением) кванта энергии.
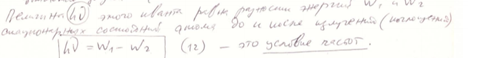
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|