
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Урок № Обратимость реакций. Химическое равновесие и условия его смещения: изменение концентрации реагирующих веществ, температуры, давления
Урок № Обратимость реакций. Химическое равновесие и условия его смещения: изменение концентрации реагирующих веществ, температуры, давления
(Билет № 5, вопрос 1).
Цель:уметь рассчитывать константу химического равновесия; определять направление смещения химического равновесия; предлагать способы смещения равновесия в нужном направлении.
Химические реакции, протекающие одновременно в двух противоположных направлениях – прямом и обратном, называются обратимыми.
2SO2 + O2 D 2SO3
Обратимые реакции характеризуются установлением химического равновесия. Это такое состояние системы, при котором скорость прямой реакции равна скорости обратной.
υпр = kпр · [A]m · [B]n υобр = kобр · [C]p · [D]g
для реакции mA + nB = pC + gD
υпр= υобр тогда,
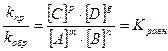 , где Kравн – константа химического равновесия
, где Kравн – константа химического равновесия
При состоянии химического равновесия в единицу времени расходуется столько же молей исходных веществ, сколько их вновь образуется, т.е. с момента наступления химического равновесия концентрации всех четырех веществ остаются без изменения, не смотря на то, что прямая и обратная реакции продолжают протекать. Состояние химического равновесия сохраняется до тех пор, пока не меняются условия равновесия.
Правило смещения химического равновесия под влиянием изменений внешних условий было сформулировано Ле-Шателье (принцип Ле-Шателье):
Если на систему, находящуюся в равновесии, производится какое-либо воздействие, то в системе возникают процессы, идущие в направлении, препятствующем этому воздействию.
Т.е. если изменить одно из условий, при которых система находится в состоянии химического равновесия, например концентрацию, температуру или давление (для газов), то равновесие смещается в сторону той реакции, которая противодействует произведенному изменению.
· При увеличении концентрации исходных веществ, то равновесие смещается в сторону образования продуктов реакции (в сторону прямой реакции, вправо);
· При увеличении концентрации продуктов реакции химическое равновесие смещается в сторону образования исходных веществ (в сторону обратной реакции, влево);
· При повышении температуры химическое равновесие системы смещается в сторону эндотермической реакции;
· При понижении температуры – в сторону экзотермического процесса; (Следует помнить, что, если прямая реакция экзотермическая, то обратная – эндотермическая.)
· При увеличении давления химическое равновесие сместится в сторону уменьшения числа молекул газообразных веществ;
· При уменьшении давления – в сторону увеличения числа молекул газообразных веществ.
Состояние химического равновесия реакций, в которых не участвуют газы, не зависит от давления.
Катализаторы никогда не смещают равновесие. Они уменьшают время, необходимое для достижения химического равновесия. Во сколько раз катализаторы ускоряют прямую реакцию, во столько же и обратную.
Решение задач:
Задание: в каком направлении сместится равновесие в следующей системе: а) при повышении температуры; б) при повышении давления; в) при повышении концентрации кислорода?
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|