
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Введение.
Определение отношения теплоёмкостей воздуха при постоянном давлении и объеме
Цель работы – изучение процессов в идеальных газах, определение отношения теплоемкости 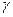 =
= 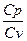
Введение.
Удельной теплоемкостью вещества называется величина, равная количеству теплоты, которую необходимо сообщить единице массы вещества для увеличения ее температуры на один кельвин:
 C=
C= 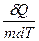 (1)
(1)
Теплоемкость одного моля вещества называется молярной теплоемкостью:
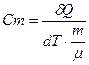 (2) где
(2) где 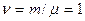

где m-масса; 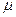 - молярная масса вещества.
- молярная масса вещества.
Значение теплоемкости газов зависит от условий их нагревания. Согласно с первым законом термодинамики количество теплоты 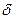 Q, сообщенное системе, расходуется на увеличение внутренней энергии dU и на выполнение системой работы
Q, сообщенное системе, расходуется на увеличение внутренней энергии dU и на выполнение системой работы 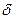 A против внешних сил:
A против внешних сил:

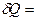 dU +
dU + 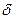 A (3)
A (3)
Увеличение внутренней энергии идеального газа в случае изменения его температуры на dT:
 (4)
(4)
где i –число степеней свободы молекулы, под которым подразумевается число независимых координат, определяющих положение молекулы в пространстве: i=3 – для одноатомных; i=5 – для двухатомных; i=6 – для трех- и многоатомных; R – универсальная газовая постоянная; R=8,31 Дж/(моль*К).
При расширении газа система выполняет работу: 


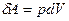 (5)
(5)
Если газ нагревать при постоянном объеме V=const, то 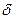 А=0 и согласно с (3) все полученное газом количестве теплоты расходуется только на увеличение его внутренней энергии
А=0 и согласно с (3) все полученное газом количестве теплоты расходуется только на увеличение его внутренней энергии 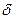
 =dU и, учитывая (4), молярная теплоемкость идеального газа при постоянном объеме
=dU и, учитывая (4), молярная теплоемкость идеального газа при постоянном объеме
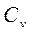 =
= 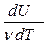 =
= 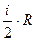 (6)
(6)
Если газ нагревать при постоянном давлении P=const, то полученное газом количество теплоты расходуется на увеличение внутренней энергии dU и выполнение работы 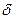 А:
А:
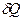 =dU+PdV
=dU+PdV
Тогда молярная теплоемкость идеального газа при постоянном давлении
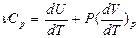 (7)
(7)
Используя уравнение состояния идеального газа (уравнение Клапейрона – Менделеева)

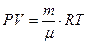 ,
,
можно доказать, что для одного моля газа
P 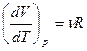
И, поэтому молекулярная теплоемкость при P=const
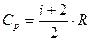 (8)
(8)
Отношение теплоемкостей:
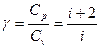 (9)
(9)
Адиабатным называется процесс, протекающий без теплообмена с окружающей средой, 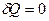
На практике он может быть осуществлен в системе, окруженной теплоизоляционной оболочкой, но поскольку для теплообмена необходимо некоторое время, то адиабатным можно считать также процесс, который протекает так быстро, что система не успевает вступить в теплообмен с окружающей средой. Первый закон термодинамики с учетом (4)-(6) для адиабатного процесса имеет вид
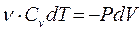 (10)
(10)
Продифференцировав уравнение Клапейрона - Менделеева
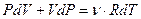
и подставив dT в формулу (10), получим
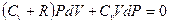
Учитывая соотношение между молярными теплоемкостями идеального газа при постоянном давлении и объеме, которое описывается формулой Майера (8), а также (9), получим
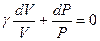
Решение написанного дифференциального уравнения имеет вид
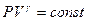 (11)
(11)
Уравнение (11) называется уравнением адиабаты (уравнением Пуассона), а введенная в (9) величина 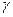 - показателем адиабаты.
- показателем адиабаты.
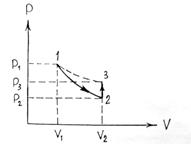
Методом определения показателя адиабаты, предложенный Клеманом и Дезормом (1819г), основывается на изучении параметров некоторой массы газа, переходящей из одного состояния в другое двумя последовательными процессами – адиабатным и изохорным. Эти процессы на диаграмме P – V (рис. 1) изображены кривыми соответственно 1-2 и 2-3. Если в баллон, соединенный с открытым водяным манометром, накачать воздух и подождать до установления теплового равновесия с окружающей средой, то в этом начальном состоянии 1 газ имеет параметры 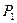 ,
, 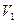 ,
, 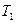 , причем температура газа в баллоне равна температуре окружающей среды
, причем температура газа в баллоне равна температуре окружающей среды 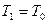 , а давление
, а давление 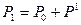 немного больше атмосферного.
немного больше атмосферного.
Если теперь на короткое время соединить баллон с атмосферой, то произойдет адиабатное расширение воздуха. При этом воздух в баллоне перейдет в состояние 2, его давление понизится до атмосферного 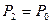 . Масса воздуха, оставшегося в баллоне, которая в состоянии 1 занимала часть объема баллона, расширяясь, займет весь объем
. Масса воздуха, оставшегося в баллоне, которая в состоянии 1 занимала часть объема баллона, расширяясь, займет весь объем 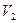 . При этом температура воздуха, оставшегося в баллоне, понизится до
. При этом температура воздуха, оставшегося в баллоне, понизится до 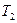 . Поскольку процесс 1-2 – адиабатный, к нему можно применить уравнение Пуассона (11)
. Поскольку процесс 1-2 – адиабатный, к нему можно применить уравнение Пуассона (11)
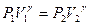 , или
, или 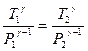
Отсюда
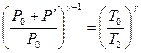 (144.12)
(144.12)
После кратковременного соединения баллона с атмосферой охлажденный из-за адиабатного расширения воздуха в баллоне будет нагреваться (процесс 2 – 3) до температуры окружающей среды 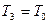 при постоянном объеме
при постоянном объеме 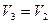 . При этом давлении в баллоне поднимется до
. При этом давлении в баллоне поднимется до 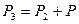 . Поскольку процесс 2-3 – изохорный, к нему можно применить закон Шарля:
. Поскольку процесс 2-3 – изохорный, к нему можно применить закон Шарля:
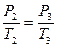 ,
,
отсюда
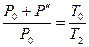 (144.13)
(144.13)
|
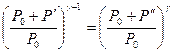
Прологарифмируем:

Поскольку избыточные давления 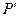 и
и 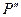 очень малы по сравнению с атмосферным давлением
очень малы по сравнению с атмосферным давлением 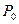 и учитывая, что при x<<1
и учитывая, что при x<<1 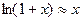 , будем иметь:
, будем иметь:
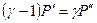 ,
,
откуда
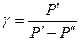 (14)
(14)
Избыточные давления 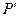 и
и 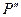 измеряют с помощью U – образного манометра по разности уровней жидкости с плотностью
измеряют с помощью U – образного манометра по разности уровней жидкости с плотностью 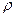 :
:
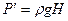 ;
; 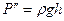 (15)
(15)
Из (14) и (15) получим расчетную формулу для определения 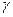 :
:
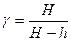 (16)
(16)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|