
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Промышленные способы получения веществ.
Промышленные способы получения веществ.
- конверсия метана, промышленный способ получения водорода.
CH4 + H2O(пар) → CO + 3H2, для разделения смеси СО и Н2 берут избыток водяного пара СО + Н2О → СО2 + Н2, углекислый газ поглощают известковой водой
- Промышленный способ получения уксусной кислоты 2С4Н10 + 5О2 → 4СН3-СООН + 2Н2О (t0, катализатор соединения марганца).
-

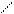 получение окиси этилены.2Н2С=СН2 + О2 → 2СН2-СН2 (2000, Ag)
получение окиси этилены.2Н2С=СН2 + О2 → 2СН2-СН2 (2000, Ag)
О
Далее на окись этилена действуют водой и получают этиленгликоль
4. промышленный способ получения сопряженных алкадиенов. CH3-CH2-CH2-CH3 → CH2=CH-CH=CH2 + 2H2 (t0 , Cr2O3, Al2O3)
5. 2C2H5OH → CH2=CH-CH=CH2 + 2H2O + H2 (t0 , ZnO, Al2O3) –реакция Лебедева.
6. HC≡CH + HCl → CH2=CHCl (AlCl3) – получение хлорвинила.
7. HC≡CH + H2O → CH3-CH=O (Hg2+, H+, t0) – реакция Кучерова.
8. 2 HC≡CH → CH≡C-CH=CH2 (CuCl, NH4Cl водные растворы) – получение винилацетилена и хлороперна . CH≡C-CH=CH2 + HCl → H2C=CCl – CH=CH2
9. 3 HC≡CH → С6Н6 (активированный С, 6000).
10. риформинг нефти, промышленный способ получения аренов.
С6Н14 → С6Н6 + 4Н2 (t0 , Cr2O3) – риформинг нефти, промышленный способ получения аренов.
11. промышленный способ получения этанола.
СН2=СН2 + H2O → CH3-CH2ОН (t0, H3PO4)
13. C6H5-CH(CH3)2 +O2 → С6Н5OH + CH3-CO-CH3 (H2SO4) – кумольный способ получения фенола и ацетона .
14. 2Н2С=СН2 + О2 → 2CH3-CH=O (PdCl2, CuCl2) промышленный способ получения уксусного альдегида.
15. NaOH + CO → HCOONa (t0, Р), 2HCOONa + H2SO4 → 2HCOOH + Na2SO4.
18. Производство азотной кислоты:
А) 4NH3 + 5O2 = 4NO + 6H2O (Pt, t0),
Б) 2NO + O2 = 2NO2 (охлаждение), В)
4NO2 + O2 + 2H2O = 4HNO3
Серная кислота.
Сырье: пирит (серный или железный колчедан) – FeS2, S, может быть H2S (выделенный из природного газа), SО2 (отходы цветной металлургии), воздух обогащенный кислородом.
| Реакция | аппарат | Технологические принципы, условия протекания реакции | Характеристика реакции |
| 4FeS2 + 11O2 = 2Fe2O3 + 8SO2 + Q – обжиг пирита, проводят в «кипящем слое» | печь для обжига в «кипящем слое» | Автотермичность, противоток. Измельчение и обогащение пирита, 8000, отведение лишнего тепла во избегании спекания Fe2O3 | Гетерогенная, не обратимая, экзотермическая |
| Аппараты очистки печного газа | |||
| аппарат | От чего очищают | Технологические принципы | |
| Циклон | От грубых твердых примесей | ||
| Электрофильтр | От тонкой пыли | ||
| Сушильная башня (используют 98% серную кислоту) | От паров воды | противоток | |
| Реакция | аппарат | Технологические принципы, условия протекания реакции | Характеристика реакции |
2SO2 + O2 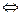 2SO3 + Q 2SO3 + Q
| контактный аппарат | Автотермичность, противоток, теплообмен. Катализатор V2O5 с промоторами, температура 420-6200. | Обратимая, каталитическая, гомогенная, экзотермическая. |
| SO3 + H2O = H2SO4 | поглотительная башня | Противоток. вместо воды используют 98%-ную серную кислоту, получают олеум (раствор SO3 в H2SO4) | Необратимая, экзотермическая, в данной ситуации необратимая. |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|