
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
h • vmn = Еm – Еn.
h • vmn = Еm – Еn.
3. Момент импульса электрона, находящегося на стационарной орбите, квантуется:
m • υn • rn = n • ħ,
где n — номер стационарной орбиты, ħ = h/2p = 1,05 • 10–34 Дж•с — постоянная Планка (аш (h) с чертой).
2.4. Спектры испускания и спектры поглощения
Атом с одним вращающимся вокруг ядра электроном называется водородоподобным атомом.
Боровская модель атома водорода описывает атом водорода и водородоподобные атомы.
Энергетический уровень — энергия, которой обладает электрон в атоме, находящемся в определенном стационарном состоянии.
Основное состояние атома — состояние с минимальной энергией.
Атом водорода имеет определенный спектр энергий. Состояние атома с n = 1 называют основным состоянием. Энергия основного состояния электрона в атоме водорода: 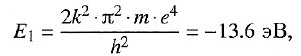
где k = 9•109 Н•м2/Кл2; m = 9,1 • 10–31 кг — масса электрона; е = –1,6 • 10–19 Кл — заряд электрона; h = 6,62 • 10–34 (Дж•с) — постоянная Планка.
Возбужденные состояния атома водорода — это состояния с номером п > 1, где п — главное квантовое число. Чем больше квантовое число п, тем дальше от ядра находится электрон, тем выше его энергетический уровень. Энергетический спектр атома водорода можно рассчитать: 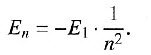
Энергетический спектр водородоподобного атома рассчитывают с учетом Z —зарядового числа химического элемента: 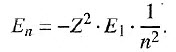
Линейчатый спектр — спектр излучения, состоящий из отдельных узких спектральных линий различной интенсивности. Излучение, которое испускают атомы, образует линейчатый спектр.

Линейчатый спектр включает в себя резко очерченные цветные линии, которые обязательно отделяются друг от друга широкими темными промежутками. Расположение спектральных линий строго упорядочено и индивидуально для каждого вещества.
Формула, позволяющая найти частоты или длины волн, соответствующие линиям водородного спектра:
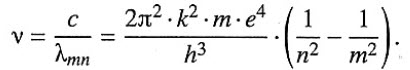
Атом испускает квант энергии, если m > n — все возможные частоты, вычисленные по данной формуле, дают спектр излучения атома водорода.
Атом поглощает квант энергии, если m < n. Спектр поглощения вещества получают, пропуская свет от источника, дающего сплошной спектр, через вещество, атомы и молекулы которого находятся в невозбужденном состоянии. Атом или молекула вещества поглощает излучение той же частоты, что и излучает, т. е. линии поглощения соответствуют линиям испускания — это закон обратимости спектральных линий Кирхгофа.
Энергетические уровни в атоме водорода принято обозначать горизонтальными линиями.

При n = 1 переходы с верхних уровней в основное состояние образуют серию Лаймана — ультрафиолетовая область спектра.
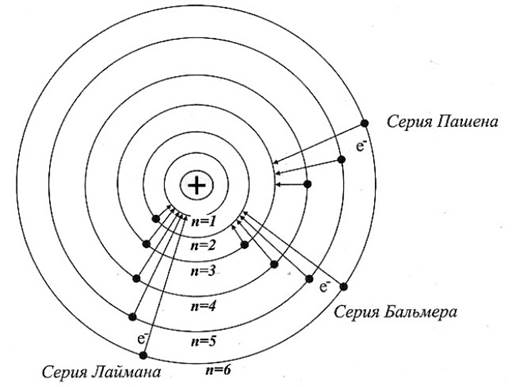
При n = 2 переходы с верхних уровней в первое возбужденное состояние образуют серию Бальмера — видимая часть спектра.
При n = 3 переходы с верхних уровней во второе возбужденное состояние образуют серию Пашена — инфракрасная часть спектра и т. д.
Формула Бальмера

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|