
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Микробиологическое исследование
Микробиологическое исследование
Микробиологическое исследование - это выделение чистых культур микроорганизмов, культивирование и изучение их свойств. Чистыми называют культуры, состоящие из микроорганизмов одного вида. Они нужны при диагностике инфекционных болезней, для определения видовой и типовой принадлежности микробов, в исследовательской работе, для получения продуктов жизнедеятельности микробов (токсинов, антибиотиков, вакцин и т. п.).
Для культивирования микроорганизмов (выращивание в искусственных условиях in vitro) необходимы особые субстраты - питательные среды. На средах микроорганизмы осуществляют все жизненные процессы (питаются, дышат, размножаются и т. д.), поэтому их еще называют средами для культивирования.
Приготовление сред
Посуда для приготовления сред не должна содержать посторонних веществ, например щелочей, выделяемых некоторыми сортами стекла, или окислов железа, которые могут попасть в среду при варке ее в ржавых кастрюлях. Лучше всего пользоваться стеклянной, эмалированной или алюминиевой посудой. Большие количества среды (десятки и сотни литров) готовят в специальных варочных котлах или реакторах (рис. 14). Перед употреблением посуду необходимо тщательно вымыть, прополоскать и высушить. Новую стеклянную посуду предварительно кипятят 30 мин в 1-2% растворе хлороводородной кислоты или погружают в этот раствор на ночь, после чего в течение часа прополаскивают в проточной воде.

Рис. 14. Общий вид реактора
Внимание! Посудой, предназначенной для приготовления сред, нельзя пользоваться в других целях, например для хранения химических реактивов или дезинфицирующих растворов - даже следы этих веществ могут помешать росту микроорганизмов.
Исходным сырьем для приготовления большинства сред служат продукты животного или растительного происхождения: мясо и его заменители, молоко, яйца, картофель, соя, кукуруза, дрожжи и др.
Основные питательные бульоны готовят на мясной воде или на различных переварах, полученных при кислотном или ферментативном гидролизе исходного сырья. Бульоны из переваров в 5-10 раз экономичнее, чем из мясной воды. Среды на переварах богаче аминокислотами, следовательно, питательнее; обладают большей буферностью, т. е. имеют более стабильную величину рН. Кроме того, перевары можно готовить из заменителей мяса (сгустков крови, плаценты, казеина и т. д.).
В настоящее время снабжение лабораторий мясной водой и переварами централизованно. Чаще пользуются панкреатическим переваром Хоттингера, гидролизатами казеина или кормовых дрожжей. Из этих полуфабрикатов по определенным рецептам готовят необходимые среды.
Этапы приготовления сред: 1) варка; 2) установление оптимальной величины рН; 3) осветление; 4) фильтрация; 5) разлив; 6) стерилизация; 7) контроль.
Варят среды на открытом огне, водяной бане, в автоклаве или варочных котлах, подогреваемых паром.
Установление рН сред ориентировочно производят с помощью индикаторных бумажек. Для точного определения рН пользуются потенциометром, применяя стеклянные электроды в соответствии с инструкцией или компаратором (аппарат Михаэлиса), состоящим из штатива с гнездами для пробирок (рис. 15) и набора стандартов определенного рН. При приготовлении сред пользуются обычно индикатором метанитрофенолом, изменяющим свой цвет в диапазоне 6,8-8,4.
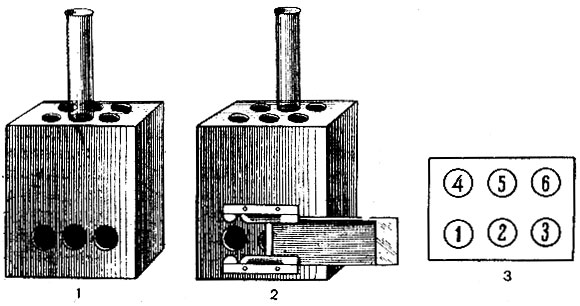
Рис. 15. Компаратор (аппарат макро-Михаэлиса). 1 - вид спереди; 2 - вид сзади; 3 - схема расположения пробирок в штативе
Для определения рН среды 4 пробирки, диаметр и цвет стекла которых не отличается от пробирок со стандартами, помещают в гнезда 1, 2, 3 и 5 (см. рис. 15). В 1-ю и 3-ю пробирки наливают по 5 мл дистиллированной воды; в 5-ю - 7 мл; во 2-ю - 4 мл воды и 1 мл индикатора. В гнезда 4 и 6 ставят стандарты нужного рН. В 1-ю, 2-ю и 3-ю пробирки наливают 2 мл охлажденной среды. Содержимое пробирок смешивают.
Цвет жидкостей в пробирках сравнивают в проходящем свете, закрыв заднюю прорезь прибора фильтром (матовым или синим, если жидкости интенсивно желтые). рН испытуемого раствора соответствует рН стандарта, с цветом которого совпадает его цвет.
Готовя среды с заданным рН, в гнезде 4 и 6 ставят стандарты, рН которых близок к требуемому, а во 2-ю пробирку с испытуемой средой и индикатором добавляют из бюретки определенное количество раствора щелочи, если жидкость во 2-й пробирке светлее стандартов, или раствора кислоты - если светлее стандарты. Щелочь (или кислоту) приливают до тех пор, пока цвет жидкости во 2-й пробирке не совпадает с цветом стандартов. Количество щелочи (или кислоты), прибавленное к 2 мл среды во 2-й пробирке, пересчитывают на весь объем приготовленной среды. Например, если для получения нужного рН на 2 мл среды пошло 2 капли (0,1 мл) 0,05 н. раствора щелочи, то для подщелачивания 1 л нужно в 500 раз больше, т. е. 50 мл 0,05 н. или 2,5 мл 1 н. раствора щелочи.
При стерилизации рН сред снижается на 0,2, поэтому для получения среды с рН 7,2-7,4 ее сначала готовят с рН 7,4-7,6.
Осветление сред производят, если при варке они мутнеют или темнеют. Для осветления в среду, подогретую до 50° С, вливают белок куриного яйца, взбитый с двойным количеством воды, перемешивают и кипятят. Свертываясь, белок увлекает в осадок взвешенные в среде частицы. Таким же способом можно вместо яичного белка использовать сыворотку крови (20-30 мл на 1 л среды).
Фильтрацию жидких и расплавленных желатиновых сред производят через влажный бумажный или через матерчатые фильтры. Фильтрация агаровых сред затруднена, - они быстро застывают. Обычно их фильтруют через ватно-марлевый фильтр (в воронку помещают марлевую салфетку и на нее пышный комок ваты). Можно пользоваться бумажными или матерчатыми фильтрами, если проводить фильтрацию в горячем автоклаве или в воронках с подогревом.
Фильтрацию агаровых сред можно заменить отстаиванием. Среду наливают в высокий цилиндрический сосуд и расплавляют в автоклаве. При медленном остывании среды в выключенном приборе взвешенные в ней частицы оседают на дно. На следующий день агаровый сгусток извлекают из сосуда (для этого сосуд ненадолго помещают в горячую воду) и отрезают ножом нижнюю часть со скопившимся осадком. Верхнюю часть растапливают и разливают в соответствующие емкости.
Разливают среды в пробирки (по 3-5 мл или по 10 мл), флаконы, колбы, матрацы и бутылки не более чем на 2/3 емкости, так как при стерилизации могут намокнуть пробки и среды утратят стерильность.
Среды, которые стерилизуют при температуре выше 100° С, разливают в чистую сухую посуду. Среды, стерилизуемые при более низкой температуре, обязательно разливают в стерильную посуду.
Разливают среды с помощью воронки, на конец которой надета резиновая трубка с зажимом Мора. Для мерного разлива применяют мензурки, бюретки, дозаторы, шприцы-пипетки и т. п. (рис. 16).
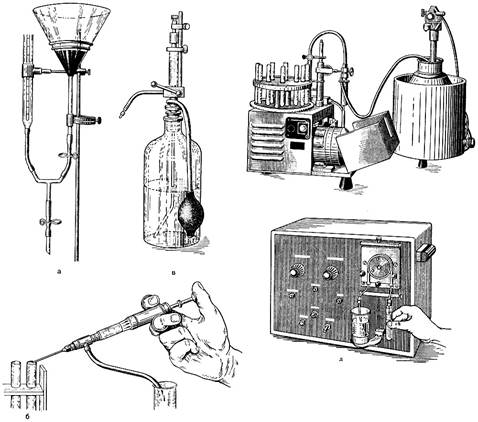
Рис. 16. Приспособления для мерного разлива сред. а - лабораторный монтаж; б - автоматический шприц-пипетка; в - дозатор; г - полуавтомат; д - автоматический дозатор
Посуду со средой обычно закрывают ватно-марлевыми пробками, поверх которых надевают бумажные колпачки. Важно, чтобы при разливе среда не смачивала края посуды, иначе к ним могут прилипнуть пробки. К каждому сосуду обязательно прикрепляют этикетку с названием среды и датой ее приготовления.
Стерилизация. Режим стерилизации зависит от состава среды и указан в ее рецепте. Примерная схема режима стерилизации сред приведена в табл. 8.
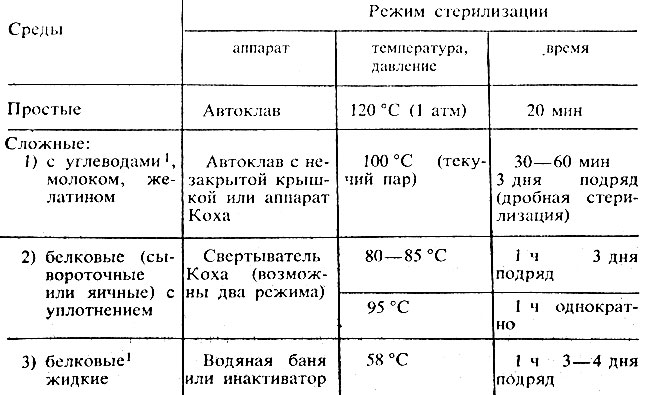
Таблица 8. Режим стерилизации сред
1 (Жидкие среды с углеводами, белками или витаминами лучше стерилизовать с помощью бактериальных фильтров.)
Контроль готовых сред: а) для контроля стерильности среды ставят в термостат на 2 сут, после чего просматривают. Если на средах не появятся признаки роста, их считают стерильными и передают для химического контроля по нескольку образцов каждой серии; б) химический контроль: окончательно устанавливают рН, содержание общего и аминного азота, пептона, хлоридов (их количество должно соответствовать указанному в рецепте).
Химический контроль сред производят в химической лаборатории; в) для биологического контроля несколько образцов среды засевают специально подобранными культурами микроорганизмов, и по их росту судят о питательных (ростовых) свойствах среды. К готовой среде прилагают этикетку и паспорт, в котором указывают название и состав среды, результаты контроля и др.
Хранят среды при комнатной температуре в шкафах, желательно специально для них предназначенных. Некоторые среды, например, среды с кровью и витаминами, хранят в холодильнике.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|