
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Рассчитайте содержание вещества (г) и массовую долю (%)
Вариант 6
Задание 1.
Ситуационная задача.
Потенциометрическое определение калия йодида.
Определение основано на установлении точки эквивалентности при титровании калия йодида раствором титранта AgNO3 по резкому изменению потенциала системы.
Методика
В стакан вместимостью 50 см3 вносят пипеткой 4,0 мл испытуемого раствора калия йодида, 20 cм3 дистиллированной воды, магнитный стержень.
Бюретку заполняют 0,05 моль/дм3 раствором нитрата серебра, закрепляют штатив. Стакан с анализируемым раствором устанавливают на столик электромагнитной мешалки, погружают в раствор электроды и титруют.
Сначала проводят ориентировочное титрование, добавляя титрант порциями по 0,5 см3.
Затем проводят точное титрование, добавляя в начале раствор титранта по 0,5 см3 до объёма, на 1 см3 меньше объёма, соответствующего точке эквивалентности в ориентировочном титровании. Далее титрант в систему добавляют порциями по 0,01 см3 со скоростью, обеспечивающей замер потенциала системы после каждой порции добавленного титранта. Содержание вещества (г) и массовую долю (%) рассчитывают по титриметрическим формулам.
| V раствора титранта, см3 | DV, см3 | Е, mВ | DЕ, mВ | DV/DЕ, см3/m В | DЕ/DV, mВ/см3 | D2Е/DV2, mВ/(см3)2 |
| 4,78 | 0,01 | 0,0025 | ||||
| 4,79 | 0,01 | 0,0025 | ||||
| 4,80 | 0,01 | 0,0025 | ||||
| 4,81 | 0,01 | 0,0025 | ||||
| 4,82 | 0,01 | 0,0025 | ||||
| 4,83 | 0,01 | 0,0000423 | ||||
| 4,84 | 0,01 | 0,0025 | ||||
| 4,85 | 0,01 | 0,0025 | ||||
| 4,86 | - | - | - | - | - |
1.В данной ситуационной задаче представлено прямое титрование.
Fэкв (AgNO3) = 1
Fэкв (KI) = 1
2. Уравнение реакции: AgNO3 + KI(разб.) → AgI(↓) + KNO3
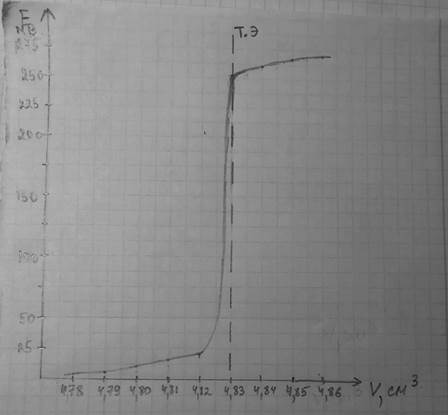
4. Графические кривые титрования:
А) интегральная кривая Е = f(V
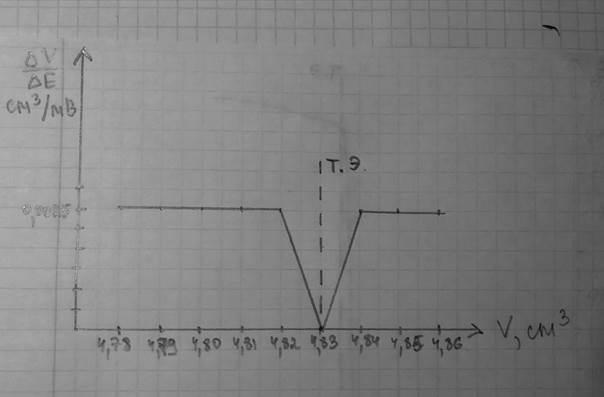
Б) дифференциальная кривая ∆V/∆Е = f(V);
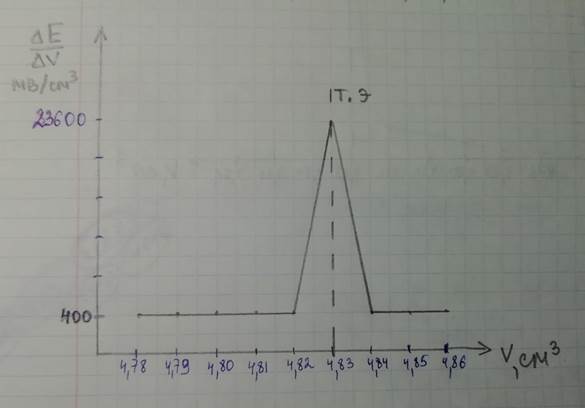
В) дифференциальная кривая ∆Е/∆V = f(V);
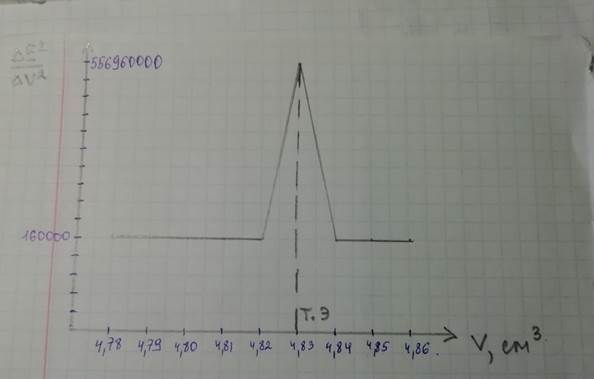
Г) кривая по второй производной ∆Е2/∆V2 = f(V).
5. Рассчитайте содержание вещества (г) и массовую долю (%)

6. Преимущества потенциометрического титрования по сравнению с классическим титриметрическим анализом:
Метод обладает высокой точностью, большой чувствительностью; позволяет проводить титрование в мутных, окрашенных, неводных средах, раздельно определять компоненты смеси в одном анализируемом растворе, например, раздельно определять хлорид- и иодид-ионы при аргентометрическом титровании.
Методами потенциометрического титрования анализируют многие лекарственные вещества, например, аскорбиновую кислоту, сульфамидные препараты, барбитураты, алкалоиды и др.
Задание 2.
Решите расчетную задачу.
Вычислите концентрацию ионов меди(II) в растворе сульфата меди(II), при условии, что электродный потенциал меди в нем равен нулю.

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|