
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Вывод уравнения Нернста
Вывод уравнения Нернста
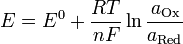 ,
,
где
· 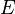 — электродный потенциал,
— электродный потенциал, 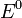 — стандартный электродный потенциал, измеряется в вольтах;
— стандартный электродный потенциал, измеряется в вольтах;
· 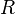 — универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль·K);
· 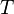 — абсолютная температура;
— абсолютная температура;
· 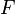 — постоянная Фарадея, равная 96485,35 Кл·моль−1;
— постоянная Фарадея, равная 96485,35 Кл·моль−1;
· 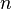 — число моль электронов, участвующих в процессе;
— число моль электронов, участвующих в процессе;
· 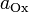 и
и 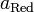 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Если в формулу Нернста подставить числовые значения констант 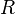 и
и 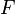 и перейти от натуральных логарифмов к десятичным, то при
и перейти от натуральных логарифмов к десятичным, то при 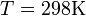 получим
получим
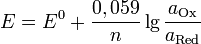
Задание для аудиторной работы:
1. Потенциал серебряного электрода в растворе АgNO3 составил 95% от значения его стандартного электронного потенциала. Чему равна концентрация ионов Аg+ (моль/л).
2. Вычислите потенциал платинового электрода в растворе сульфата железа (II), на 99 % оттитрованного раствором перманганата калия
3. Рассчитать потенциал свинцового электрода, погруженного в насыщенный раствор йодида свинца PbI2.
Задания для самостоятельной работы:
1. Составить схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению: Cu + 2AgNO3 = Cu(NO3)2 + 2Ag. Напишите уравнения анодного и катодного процессов. Вычислите ЭДС этого элемента, если [Cu2+] = 0,1 моль/л, [Ag+] = 0,01 моль/л.
2. Вычислите электродный потенциал цинка, опущенного в раствор его соли с концентрацией ионов Zn2+ = 0,001 моль/л.
3. Магниевую пластинку опустили в раствор магния. При этом потенциал металла оказался равным –2,41В. Вычислите концентрацию ионов магния (моль/л).
Контрольные вопросы:
1. Напишите математическое выражение уравнения Нернста.
2. Где находит свое применение уравнение Нернста?
3. Приведите полную классификацию электродов первого и второго рода.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|