
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Общие химические свойства.
Гетероциклические соединения. Нуклеиновые кислоты.
https://youtu.be/Td15aK0w9uM Нукленовые кислоты.
Гетероциклическими называют соединения циклического строения, содержащие в цикле не только атомы углерода, но и атомы других элементов (гетероатомы). Гетероциклические соединения – самая распространенная группа органических соединений. Гетероциклы – самый многочисленный класс органических соединений, на долю которого приходится около 2/3 всех известных природных и синтетических органических веществ. Они входят в состав многих веществ природного происхождения, таких как нуклеиновые кислоты, хлорофилл, гем крови, алкалоиды, пенициллины, многие витамины. Гетероциклические соединения играют важную роль в процессах метаболизма, обладают высокой биологической активностью. Значительная часть современных лекарственных веществ содержит в своей структуре гетероциклы
https://youtu.be/u1zv9VGTGQU
https://youtu.be/WMh6DeMxfy8
Классификация.
Для классификации гетероциклических соединений используют следующие признаки:
·по размеру цикла (пяти- и шестичленные гетероциклы),;
· по типу элемента, входящего в состав цикла (содержащие в качестве гетероатомов азот, кислород и серу) ;
· по числу гетероатомов, входящих в цикл ( один, два три, четыре, пять и более атомов );
· по природе и взаимному расположению нескольких гетероатомов;
·по степени насыщенности (различают насыщенные, ненасыщенные и ароматические гетероциклы);
· по числу циклов(моно-, ди-, тригетероатомные кольца, конденсированные системы).
Номенклатура.Присутствие гетероатома в цикле указывается специальными префиксами: О-оксо, S-тиа, N-аза. Согласно номенклатуре ИЮПАК величину цикла обозначают суффиксами: 5-членный - ол, 6-членный -ин.Для многих гетероциклических соединений сохраняются тривиальные названия.
Пятичленные гетероциклы с одним гетероатомом.
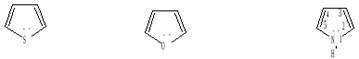
Ароматичность. Пятичленные гетероциклы с одним гетероатомом – пиррол, фуран и тиофен - представляют собой плоские пятиугольники с четырьмя атомами углерода и соответствующим гетероатомом – азотом, кислородом или серой.
1 N H пиррол, O фуран, S тиофен .
Ароматический секстет π-электронов в этих молекулах образуется за счет π-электронов атомов углерода и неподеленных электронов гетероатомов. Теория резонанса подтверждает ароматический характер фурана, пиррола и тиофена. Пиррол, фуран и тиофен относятся к π-избыточным гетероциклам, так как в них число электронов, образующих ароматическую систему, превышает общее число атомов в цикле (соотношение равно 6:5). Поскольку пиррол, фуран и тиофен имеют сходное электронное строение, в их химическом поведении имеется много общего.
Химические превращения гетероциклов можно классифицировать следующим образом:
· кислотно-основные превращения с участием гетероатома;
· реакции присоединения;
· реакции замещения;
· реакции замены гетероатома.
Основу химии пиррола, тиофена и фурана определяет способность этих соединений с легкостью вступать в реакции электрофильного замещения, преимущественно по α-положению. В сильнокислой среде ароматическая система пиррола и фурана нарушается вследствие протонирования по атомам углерода. Поэтому их относят к ацидофобным соединениям, т.е. не выдерживающим присутствия кислот. Тиофен, в отличие от пиррола и фурана, устойчив к действию сильных кислот и не относится к ацидофобным гетероциклам.
Относительная активность пятичленных гетероциклов в реакциях SE снижается в ряду: пиррол > фуран > тиофен > бензолсвязи с повышенной чувствительностью пятичленных гетероароматических соединений к сильным кислотам в ряде их реакций электрофильного замещения применяют модифицированные электрофильные реагенты.
Пятичленные гетероциклы с одним гетероатомом:
 тиофен фуран пиррол (тиол) (оксол) (азол)
тиофен фуран пиррол (тиол) (оксол) (азол)
Положения 2,5 в названиях замещенных гетероциклов указывают буквой α; 3,4 - β.
Получение. а) Пиррол, фуран, тиофен и их производные получают синтетически, при переработке некоторых природных продуктов,например белков, углеводов, а также выделяют из каменноугольной смолы.
б) Взаимные каталитические превращения. Над катализатором Al2О3 при нагревании до 400-5000С возможны превращения (цикл Юрьева):
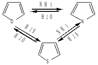 Реакцию открыл в 1936 году Ю.К. Юрьев.
Реакцию открыл в 1936 году Ю.К. Юрьев.
Эти три гетероцикла связаны друг с другом. Советский химик Ю.К. Юрьев показал, что пиррол, тиофен и фуран легко превращаются друг в друга, если нагревать их с парами воды, аммиака и сероводородом в присутствии катализатора оксида алюминия. Практическое значение имеют синтезы пиррола и тиофена из более доступного фурана. Эти синтезы протекают с выходами до 40%. Взаимные превращения других гетероаренов проходят с низкими выходами (2-3 %).
Строение. Молекулы пиррола, фурана и тиофена плоские, содержат систему сопряженных связей и гетероатом с неподеленной электронной парой. Общее количество электронов в кольце равно 6 (4 π-электрона от двух двойных связей и 2р от гетероатома), что соответствует правилу Хюккеля. Таким образом, эти соединения имеют ароматические характер. Неподеленная электронная пара на гетероатоме действует как электронодонор, поэтому на углеродных атомах цикла электронная плотность увеличивается, а на гетероатоме - уменьшается. Делокализация электронов в гетероциклах по сравнению с бензолом меньше и уменьшается в следующем направлении: бензол > тиофен > пиррол > фуран.
 Физические и химические свойства. Пиррол, фуран и тиофен - бесцветные жидкости с приятным запахом. Тиофен - запах похож на запах бензола. По химическим свойствам сходен с бензолом. Фуран (фурфуран), имеющий запах хлороформа. Пиррол -бесцветная жидкость, буреющая на воздухе. Запах пиррола напоминает запах хлороформа.
Физические и химические свойства. Пиррол, фуран и тиофен - бесцветные жидкости с приятным запахом. Тиофен - запах похож на запах бензола. По химическим свойствам сходен с бензолом. Фуран (фурфуран), имеющий запах хлороформа. Пиррол -бесцветная жидкость, буреющая на воздухе. Запах пиррола напоминает запах хлороформа.
Общие химические свойства.
а) Реакции замещения.Реакционная активность уменьшается в следующем направлении – пиррол > фуран > тиофен ≈ бензол. Реакции электрофильного замещения (галогенирование, нитрование, сульфирование, алкилирование и ацилирование - см. «Арены») осуществляются в положении 2 (α), протекают в отсутствии ионов водорода Н+ и действия очень слабых электрофилов.
б) Каталитическое гидрирование. Водород присоединяется в присутствии катализаторов (Ni,Pt,Pd) при нагревании, при этом образуются тетрагидропроизводные (тетрафуран, тетрапиррол, тетратиофен):
Тиофен. При восстановлении тиофена образуется тетрогидротиофен: Производным тетрогидротиофена является биотин или витамин Н, или коэнзим R. Молекула биотина состоит из конденсированных тетрогидротиофена, мочевины и валериановой кислоты. 2 Он входит в состав биотиновых ферментов, которые катализируют реакции карбоксилирования и транскарбоксилирования при синтезах высших жирных кислот, белков, пуриновых нуклеотидов. Содержится во всех продуктах животного и растительного происхождения, а также синтезируется микрофлорой кишечника. Недостаточность проявляется в случае употребления большого количества сырого яичного белка или приема сульфаниламидных препаратов и антибиотиков, подавляющих рост бактерий в кишечнике. У человека при недостаточности биотина возникают дерматиты, анемии, депрессии. Производные тиофена содержатся в медицинском препарате ихтиоле, который обладает противовоспалительным, антисептическим и местным обезболивающим действием.
Фуран (фурфуран). Важнейшее производное фурана – фурфурол или а-фуран- 2-альдегид: Получают из пентоз при нагревании их с кислотами. В малых концентрациях он обладает приятным запахом, напоминающих запах свежего ржаного хлеба; в больших концентрациях пахнет неприятно, раздражая слизистые оболочки. По химическим свойствам сходен с ароматическими альдегидами. Из фурфурола получают 5-нитропроизводные, обладающие сильным бактерицидным действием: фурацилин, фуразолидон:
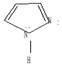
Пиррол. Ароматические свойства пиррола выражены слабее, чем у тиофена. Продуктом полного восстановления пиррола является пирролидин. Ядро пирролидина входит в состав никотина, пролина и гидроксипролина: Пролин (а-пирролидин карбоновая кислота) – аминокислота, образующаяся при гидролизе белков. Остаток пролина участвует в построении молекулы антибиотика – грамицидина С. Ядра пиррола и его продуктов восстановления содержатся в гемоглобине, хлорофилле, витамине В 12, желчных пигментах, образующихся в организме при разрушении гемоглобина. В ряде важных соединений ядро пиррола встречается в виде конденсированной системы, состоящей из пиррола и бензола. Такая система называется индол, или бензопиррол. Свое название индол получил в связи с тем, что впервые был получен из синего красителя индиго.
Природные соединения гетероциклов.Пиррол образует порфирины (содержат 4 молекулы пиррола), которые входят в состав природных соединений, например гема - небелковой части гемоглобина, хлорофилла, витамина В12. Группировка пиррола с бензолом (индол) содержится в триптофане, серотонине, некоторых алкалоидах (резерпин, лизергиновая кислота и т.д.).
Наиболее важные пятичленные гетероциклы с двумя атомами азота:
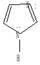 пиразол имидазол
пиразол имидазол
Соединения проявляют амфотерные свойства.
Имидазол (1,3-диазол) входит в состав пуриновых оснований, из него получают лекарственные препараты - антипирин, амидопирин, анальгин и т.д.
-Красное вещество крови гемоглобин . Переносящий кислород из легких в каждую клетку тела, является хромопротеидом, состоящим из белка глобина и окрашенной в красный цвет небелковой части — гема. Гем является порфирином, содержащим Fe (III). Строение гемв выяснил и осуществил синтез Г.Фишер в 1927 году.
-Хлорофиллы в процессе фотсинтеза трансформируют световую энергию в химическую. Его структуру установили в 1913-1938 годах; полный синтез осуществлен Р.Вудвордом в 1956 году.
-Строение витамина В12 — темно-красного кристаллического вещества, установлено Д.Кроуфтом в 1950 году, полный синтез витамина осуществлен Р.Вудвордом в 60-десятых годах 20 века. Это одно из выдающихся достижений органического синтеза.
Шестичленные гетероциклы с одним гетероатомом.
Пиридин – наиболее типичный представитель ароматических гетероциклов. Производные пиридина широко представлены среди веществ, имеющих важное биологическое значение. 3-Метилпиридин – важный синтетический предшественник пиридин-3-карбоновой (никотиновой) кислоты – представителя витаминов В. Амид никотиновой кислоты (никотинамид) – структурный компонент коферментов никотинамидадениндинуклеотида (НАД+ ) и никотинамидадениндинуклеотидфосфата (НАДФ+ ). Последний кофермент (один из комплекса витаминов В2 , входит в состав эритроцитов и принимает участие в важных биохимических процессах. Молекула пиридина отвечает критериям ароматичности, сформулированным для ароматических углеводородов.
Шестичленные азотсодержащие гетероциклы с одним и двумя гетероатомами:
Пиридин (азин) – 6-членный ароматический гетероцикл с одним атомом азота.
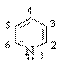
Ароматическая система пиридина включает 6 π-электронов и подобна ароматической системе бензола: каждый атом цикла подает в ароматический секстет один р-электрон. Неподеленная пара электронов азота в силу своей пространственной ориентации в сопряжении не участвует:

Атом азота действует как акцептор и понижает электронную плотность на атомах углерода цикла в положениях 2, 4, 6:
 Химические свойства пиридина определяются наличием ароматической системы (электрофильное замещение в 3 и 5 положениях кольца, по активности в этих реакциях уступает бензолу) и основного атома азота (образует соли). Нуклеофильное замещение протекает в положениях 2,4 или 6. Пиридин и метилпиридины (пиколины) — бесцветные жидкости с неприятным запахом, получают из каменноугольной смолы и широко используют в органическом синтезе. При окислении алколоида — никотина впервые была получена никотиновая кислота (3-карбоксипиридин), являющаяся провиамином, а её амид — витамином РР. Недостаток этого витамина вызывает заболевание кожи, называемое пеллагрой.
Химические свойства пиридина определяются наличием ароматической системы (электрофильное замещение в 3 и 5 положениях кольца, по активности в этих реакциях уступает бензолу) и основного атома азота (образует соли). Нуклеофильное замещение протекает в положениях 2,4 или 6. Пиридин и метилпиридины (пиколины) — бесцветные жидкости с неприятным запахом, получают из каменноугольной смолы и широко используют в органическом синтезе. При окислении алколоида — никотина впервые была получена никотиновая кислота (3-карбоксипиридин), являющаяся провиамином, а её амид — витамином РР. Недостаток этого витамина вызывает заболевание кожи, называемое пеллагрой.
Пиримидин (1,3-диазин) – 6-членный ароматический гетероцикл с двумя атомами азота:
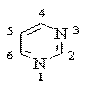
Ароматическая система пиримидина подобна ароматической системе пиридина.
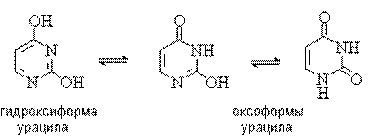
Важную биологическую роль играют гидрокси- и аминопроизводные пиримидина: урацил, тимин и цитозин – нуклеиновые основания; входят в состав нуклеозидов, нуклеотидов, нуклеиновых кислот. Существуют в таутомерных оксо- и гидроксиформах:
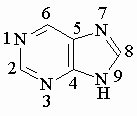
Пурин – ароматическое гетероциклическое соединение, содержащее конденсированные пиримидиновый и имидазольный циклы:
Пурин, подобно имидазолу, существует в виде двух таутомерных форм. Более стабильной является форма с атомом водорода в положении 7:
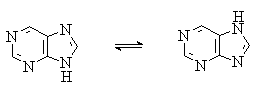
Гидрокси- и аминопроизводные пурина: аденин и гуанин - нуклеиновые основания; входят в состав нуклеозидов, нуклеотидов, в том числе нуклеотидных коферментов, нуклеиновых кислот.
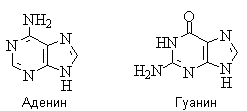
Для аденина известны две таутомерные формы, являющиеся результатом миграции протона между атомами азота имидазольного цикла. У гуанина существуют таутомерные гидрокси- и оксоформы:
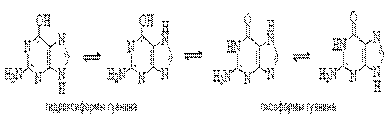
Стабильными таутомерными формами гуанина являются оксо-формы.
Нуклеиновые кислоты
Нуклеиновые кислоты (ДНК и РНК) – биополимеры, которые содержатся в клетках любого живого организма и выполняют важнейшие функции по хранению и передаче генетической информации, участвуют в механизмах ее реализации в процессе синтеза клеточных белков.
В результате последовательного гидролитического расщепления ДНК и РНК можно выделить следующие структурные компоненты: полинуклеотиды → нуклеотиды (рибоза или 2-дезоксирибоза + азотистое основание + фосфорная кислота) → нуклеозиды (азотистое основание + углевод) .
Азотистые основания: пиримидиновые, пуриновые.
Пиримидиновые основания- производные пиримидина. Это- урацил, тимин, цитозин.
Пуриновые основания- производные пурина. Это – аденин, гуанин.
https://youtu.be/V6YC97Dj5E0
https://youtu.be/Td15aK0w9uM
Учебник «Репетитор по химии под ред. А.С.Егорова» § 11.4 стр. 714-723.
Таблицы стр.719, 720.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|