
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Практическая работа № 3. Определение рН растворов солей. Теоретическая часть. Ход работы
Практическая работа № 3
Определение рН растворов солей
Цель: опытным путем изучить свойства растворов солей
Теоретическая часть
Гидролиз – взаимодействие соли и воды. Гидролизу подвергаются соли, образованные сильным основанием и слабой кислотой ( или наоборот), а также слабыми основаниями и кислотами.
Соли образованные сильным основанием и сильной кислотой гидролизу не подвергаются. Растворы солей, образованные сильным основанием и слабой кислотой имеют щелочную среду ( рН >7); растворы солей образованных слабым основанием и сильной кислотой имеют имеют кислую среду (рН<7). Соли образованные сильным основанием и сильной кислотой и слабым основанием и слабой кислотой – нейтральные (рН=7).
Определить рН раствора можно с помощью индикаторов на основе изменения их окраски. Наиболее часто применяемые индикаторы: лакмус и фенолфталеин.
| индикатор | кислая среда | нейтральная | щелочная |
| лакмус | красный | фиолетовый | синий |
| фенолфталеин | бесцветный | бесцветный | малиновый |
Оборудование: растворы солей (хлорида алюминия, сульфида натрия, хлорида железа(II)), индикаторы, химическая посуда и оборудование.
Ход работы
ЗаданиеРеакции солей растворов, как следствие их гидролиза
Выданные образцы солей растворить в воде
Задания для самостоятельных выводов:
Определить окраску универсального индикатора, реакцию среды и рН раствора
Определить основание и кислоту, которыми образованы соли
Составить молекулярные и ионные уравнения реакций гидролиза
Составить отчет о выполненной работе, заполнив таблицу
Образец выполнения
| Формулы растворенных соли | Окраска универсального индикатора | Реакция среды | рН раствора | Основания и кис лоты, которыми образованы соли |
| Na2CO3 | Зеленый | Щелочная | NaOH – сильное основание Н2СО3 – слабая к-та | |
| BaCl2 (NaCl) | Светло-желтый | Нейтральная | Ва(ОН)2 – сильное основание НСl – сильная к-та | |
| Pb(NO3)2 | Желто-зеленый | Кислая | Pb(OH)2 –слабое основание HNO3 – сильная к-та |
Первый случай. Соль Na2CO3 образована сильным основанием NaOH и слабой кислотой H2CO3.
Подвергается гидролизу по аниону: СО32- + H2O 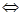 HСО3 - + ОH-
HСО3 - + ОH-
Na2CO3 + H2O 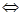 NaHCO3 + NaOH
NaHCO3 + NaOH
Продуктом гидролиза является основание, значит среда раствора – шелочная.
Второй случай. Соль BaCl2 образована сильным основанием Ва(ОН)2 и сильной кислотой HCl, поэтому гидролизу не подвергается.
Третий случай. Соль Pb(NO3)2 образована слабым основанием Pb(OH)2 и сильной кислотой HNO3. Подвергается гидролизу по катиону: Pb2+ + H2O 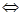 PbOH+ + H+
PbOH+ + H+
Pb(NO3)2 + H2O 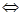 PbOHNO3 + HNO3
PbOHNO3 + HNO3
Продуктом гидролиза является кислота, значит среда раствора – кислая
По образцу вы расписываете соли подчеркнутые в оборудовании.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|