
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Ход урока. Длина связи
Ход урока
Ковалентная связь – химическая связь, образованная перекрыванием электронных облаков атомов. Электронные облака (электроны), обеспечивающие связь, называются общей электронной парой.
Различают два механизма образования ковалентной связи: обменный и донорно-акцепторный.
При обменном механизме каждый атом предоставляет по одному электрону для образования общей пары:
А·+ В = А:В
При донорно-акцепторном механизме один атом предоставляет уже имеющуюся у него пару электронов (донор), а другой атом предоставляет свободную орбиталь для этой пары электронов (акцептор):
А: + □В = А:В
Связь, осуществляемая за счет образования общих электронных пар, в одинаковой мере принадлежащих обоим атомам, называется ковалентной неполярной.
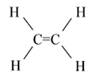
Ковалентная неполярная связь образуется между атомами неметаллов с одинаковыми значениями относительной электроотрицательности, например в молекулах хлора, азота, между атомами углерода в этилене (табл. 1).
| Молекулярные формулы | Электронные формулы | Графические формулы |
| Cl2 | 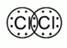
| 
|
| N2 | 
| 
|
| C2H4 | 
| 
|
Табл. 1. Примеры соединений, в которых присутствуют ковалентные неполярные связи
Число общих электронных пар зависит от того, сколько электронов не хватает каждому атому для октета. Хлор – элемент VII-А подгруппы, следовательно, на его внешнем электронном слое 7 электронов. До октета не хватает одного электрона, значит, будет образована одна общая пара электронов в Cl2. Между атомами азота в молекуле N2 образуются три общие электронные пары, т. е. тройная ковалентная связь. Между атомами углерода в этилене образуется двойная ковалентная связь.
Обратите внимание, что из каждого правила есть исключения и правило октета не всегда выполняется (пример – молекула сернистого газа SO2).
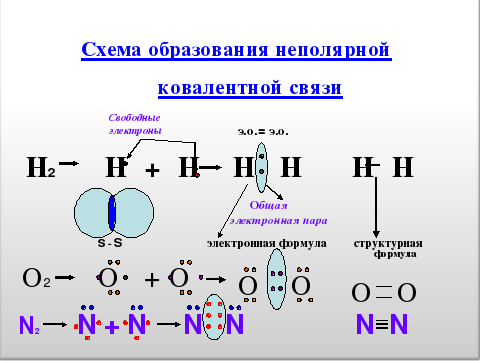
Образование химической связи в молекуле Cl2
Атом хлора находится в VIIA группе Периодической системы, значит, у него семь электронов на внешнем энергетическом уровне и ему не хватает всего одного электрона для его завершения. Шесть электронов внешнего уровня образуют пары, а один неспаренный. Два атома хлора, у которых есть по одному неспаренному электрону, сближаются, эти электроны «объединяются» и становятся общими для обоих атомов, уровень при этом становится завершенным – восьмиэлектронным. Общую пару электронов можно обозначить просто черточкой.
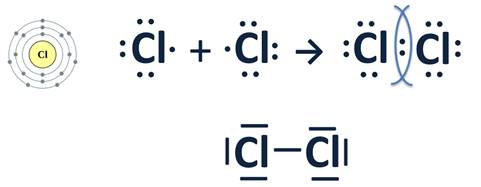
Ковалентная связь, или атомная, – это химическая связь, возникающая в результате образования общих электронных пар.
Эта химическая связь образуется между атомами одного и того же неметалла, при этом общие электронные пары, которые образовались, принадлежат обоим атомам в равной степени и ни на одном из них не будет ни избытка, ни недостатка отрицательного заряда, поэтому эта ковалентная связь называется неполярной.
Образование химической связи в молекуле Н2
Аналогично, образуется и молекула Н2. Однако атом водорода находится в IA группе, поэтому у каждого атома водорода только один электрон и до завершения внешнего энергетического уровня ему не хватает всего одного электрона (для атомов водорода и гелия уровень считается завершенным, если на нем 2 электрона). Каждый атом водорода имеет по одному электрону и эти неспаренные электроны объединяются, образуя общую электронную пару, которую также можно обозначить в виде черточки.
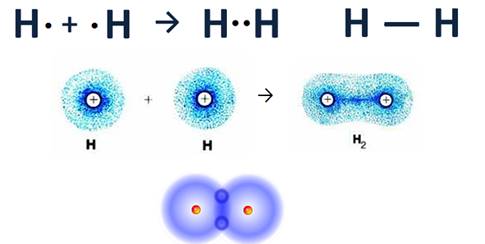
Кроме того, при сближении двух атомов водорода, каждый из которых имеет по одному s-электронному облаку сферической формы, происходит перекрывание этих электронных облаков. При этом образуется область, где плотность отрицательного заряда велика, положительно заряженные ядра притягиваются к ней, и образуется молекула.
Механизм образования более сложной молекулы О2
Кислород находится в VIA группе, следовательно, у него 6 электронов на внешнем уровне. А для того чтобы определить число неспаренных электронов, можно использовать формулу 8 – N, где N – номер группы. Поэтому у каждого атома кислорода будет по 2 неспаренных электрона, которые и будут участвовать в образовании химической связи. Эти два неспаренных электрона объединяются с двумя другими неспаренными электронами другого атома и образуется две общие электронные пары, что условно можно изобразить в виде двух чёрточек.
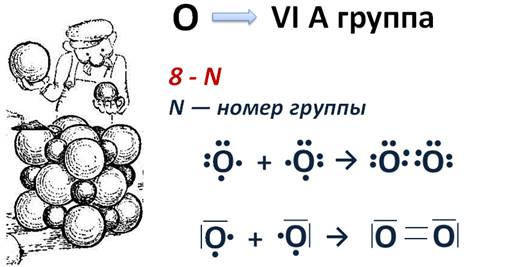
Так как, связь в молекуле кислорода состоит из двух электронных пар, ее называют еще двойной, она будет буде более прочной, чем одинарная, как в молекуле водорода. Чем прочнее связь между атомами в молекуле, тем меньше расстояние между ядрами атомов. Это расстояние называется длиной связи. Тройная связь еще короче двойной, но гораздо прочнее. Например, в молекуле азота тройная связь, для того чтобы разделить молекулу на два атома необходимо затратить в семь раз больше энергии, чем для разрыва одинарной связи в молекуле хлора.
Длина связи

|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|