
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ЛАБОРАТОРНАЯ РАБОТА № 1-11. ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЯ АДИАБАТЫ ДЛЯ ВОЗДУХА. ВВЕДЕНИЕ
ЛАБОРАТОРНАЯ РАБОТА № 1-11
ОПРЕДЕЛЕНИЕ ПОКАЗАТЕЛЯ АДИАБАТЫ ДЛЯ ВОЗДУХА
Цель работы: определить отношение теплоемкости воздуха при постоянном давлении к теплоемкости воздуха при постоянном объёме. Изучить термодинамические процессы в газах.
ВВЕДЕНИЕ
Теплоемкостью тела СТ называется величина, равная количеству теплоты  , необходимому для нагревания вещества на 1 К:
, необходимому для нагревания вещества на 1 К:
 . (1)
. (1)
Обозначение 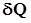 говорит о том, что теплота есть функция процесса.
говорит о том, что теплота есть функция процесса.
Удельной теплоемкостью вещества Суд называется величина, равная количеству теплоты 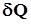 , необходимому для нагревания 1 кг вещества на 1 К:
, необходимому для нагревания 1 кг вещества на 1 К:
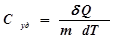 . (2)
. (2)
Молярной теплоемкостью вещества Смол называется величина, равная количеству теплоты 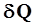 , необходимому для нагревания 1 моль вещества на 1 К:
, необходимому для нагревания 1 моль вещества на 1 К:
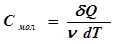 . (3)
. (3)
Величины Суд и Смол являются характеристиками вещества и зависят от процесса, в котором веществу сообщается теплота 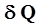 . Различают теплоемкости при постоянном объёме (СV) и постоянном давлении(С Р), если в процессе нагревания вещества его объём или давление поддерживаются постоянными.
. Различают теплоемкости при постоянном объёме (СV) и постоянном давлении(С Р), если в процессе нагревания вещества его объём или давление поддерживаются постоянными.
Если нагревать вещество при постоянном объёме, то все количество теплоты, сообщаемое веществу, полностью идет на увеличение его внутренней энергии. Если нагревать вещество при постоянном давлении, то количество теплоты, сообщаемое веществу, идет на увеличение его внутренней энергии и на работу изобарического расширения, поэтому СР больше, чем СV. Молярные теплоемкости СР мол и СV мол связаны между собой уравнением:
С Р мол - СVмол = R, (4)
где R – универсальная газовая постоянная.
Уравнение (4) называется уравнением Майера. Физический смысл величины R – она равна работе, требуемой для увеличения объёма 1 моль газа при изменении его температуры на 1 К при постоянном давлении.
При постоянном объёме: 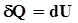 , здесь
, здесь 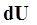 - изменение внутренней энергии. Такое обозначение говорит о том, что внутренняя энергия есть функция процесса. Поскольку изменение внутренней энергии равно:
- изменение внутренней энергии. Такое обозначение говорит о том, что внутренняя энергия есть функция процесса. Поскольку изменение внутренней энергии равно:
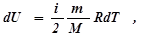 (5)
(5)
то, сопоставляя (3) и (5), получим:
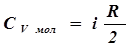 , (6)
, (6)
здесь 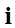 - число степеней свободы. С учетом (4) имеем:
- число степеней свободы. С учетом (4) имеем:
 . (7)
. (7)
Существует две формы передачи энергии от одних тел к другим: теплота и работа. Опыт показывает, что, в соответствии с законом сохранения энергии, при любом способе перехода системы из первого состояния во второе изменение внутренней энергии 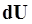 будет одинаковым и равным разности между количеством теплоты
будет одинаковым и равным разности между количеством теплоты 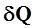 , полученным системой и работой
, полученным системой и работой 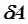 , совершаемой системой против внешних сил. Отсюда следует, что:
, совершаемой системой против внешних сил. Отсюда следует, что:
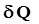 =
= 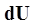 +
+  . (8)
. (8)
Уравнение (8) выражает первый закон термодинамики: количество теплоты, сообщаемое системе, идет на изменение её внутренней энергии и на совершение системой работы против внешних сил.
Среди различных термодинамических процессов чаще рассматриваются следующие: 1 - изохорный: 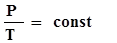 -закон Шарля. 2 - изобарный:
-закон Шарля. 2 - изобарный: 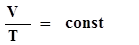 - закон Гей-Люссака. 3 - изотермический:
- закон Гей-Люссака. 3 - изотермический: 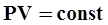 - закон Бойля-Мариотта. 4 - адиабатный:
- закон Бойля-Мариотта. 4 - адиабатный: 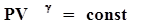 - закон Пуассона, здесь g - показатель адиабаты, равный отношению теплоемкостей:
- закон Пуассона, здесь g - показатель адиабаты, равный отношению теплоемкостей:
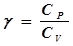 . (9)
. (9)
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|