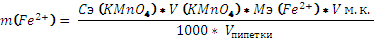- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Лабораторная работа 4
Лабораторная работа 4
Тема: «Определение содержания железа (II) в растворе».
Метод: окислительно – восстановительное титрование (редоксметрия).
Способ: прямое титрование.
Рабочий раствор: раствор перманганата калия (вторичный стандартный раствор).
Определяемое вещество: соль железа (II).
Индикатор: рабочий раствор служит индикатором.
Реакция при титровании:
10 FeSO4 + 2 KMnO4 + 8 H2SO4 = 2 MnSO4 + 5 Fe2(SO4)3 + K2SO4 + 8 H2O
 2 MnO4 - + 8 H+ + 5e = Mn2+ + 4 H2O, E0 = 1,51 В
2 MnO4 - + 8 H+ + 5e = Mn2+ + 4 H2O, E0 = 1,51 В
 5 2Fe2+ - 2e = 2 Fe3+, E0 = 0,77 В
5 2Fe2+ - 2e = 2 Fe3+, E0 = 0,77 В
2 MnO 4- + 16 H+ + 10 Fe2+ = 2 Mn2+ + 10 Fe3+ + 8 H2O
Ход определения:
Исследуемый раствор, содержащий соль железа (II), в мерной колбе на 50,0 мл довести до метки дистиллированной водой и тщательно перемешать. В колбу для титрования отобрать пипеткой Мора 10,00 мл исследуемого раствора и добавить 10 мл раствора серной кислоты с Сэ = 2,00 моль/л. Исследуемый раствор титруют раствором перманганата калия до точки эквивалентности. В точке эквивалентности раствор окрашивается в розовый цвет от одной избыточной капли перманганата калия. Проводят не менее трех параллельных титрований, отличающихся на величину, не превышающую 0,1-0,15 мл.
Вычисление результатов анализа:
Для расчетов используют среднее значение объема раствора перманганата калия:
V1 =
V2 =
V3 =
Vср. = (среднее арифметическое результатов трех титрований)
Расчет содержания железа (II) в исследуемом растворе вычисляем по формуле:
|
Мэ (Fe2+) = 55,85 г/моль
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|