
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Введение. Обработка результатов опыта
Федеральное агентство по образованию Российской Федерации
ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Физико-технический институт
Кафедра водородной энергетики и плазменных технологий
Физика
Лабораторная работа №1-34
Определение отношения теплоемкости газов (СP/СV) способом Дезорма и Клемана.
Исполнитель:
Студент, группы 0Б02 ( ) Наумова М. А.
подпись
( )
дата
Руководитель, __________ (_______) Мельникова Т. Н.
подпись
(_______)
дата
Томск –2011
Цель работы: определить отношения теплоемкостей (Сp/Сv) для воздуха.
Приборы и принадлежности: стеклянные баллоны, U-образный водяной манометр, ручной насос.
Введение
По определению теплоёмкости
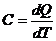 . (1)
. (1)
Газ, получая тепло, изменяет свой объём и совершает работу, а также изменяет свою внутреннюю энергию. По первому закону термодинамики
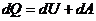 , (2)
, (2)
Где 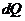 - теплота, переданная газом;
- теплота, переданная газом; 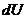 - изменение внутренней энергии газа;
- изменение внутренней энергии газа; 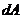 - работа, совершаемая газом.
- работа, совершаемая газом.
Элементарная работа, совершаемая газом при изменении его объёма, определяется
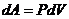 , (3)
, (3)
Где P – давление газа; dV – изменение объёма.
При изохорном процессе V=const, dV=0 (dA=0), а поэтому теплоёмкость газа, сохраняющего неизменённый объём,
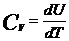 . (4)
. (4)
При изобарном процессе остаётся неизмененном давление газа, т. е. P=const. Величину PdV найдём, используя уравнение Менделеева-Клайперона
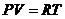 . (5)
. (5)
Продифференцируем уравнение(5) для случая
P=const,
PdV=RdT. (6)
Таким образом, теплоёмкость газа при постоянном давлении определяется
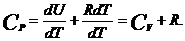 (7)
(7)
Из уравнения (7) видно, что всегда 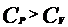 . Непосредственное определение теплоёмкости довольно затруднительно, особенно
. Непосредственное определение теплоёмкости довольно затруднительно, особенно  .
.
Отношение теплоемкости при постоянном давление
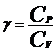 (8)
(8)
Адиабатический процесс – это процесс, протекающий без теплообмена с окружающей средой.
Применяем первое начало термодинамики к адиабатному процессу

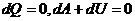 или
или 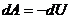 ,
,
Т. е при адиабатном процессе работа совершается газом, только за счет изменения внутренней энергии.
Из уравнения (4), (6), (7) и (8), можно получить связь между давление и объемом при адиабатном процессе
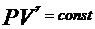 , (уравнение Пауссона),
, (уравнение Пауссона),
где 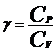 -показатель адиабаты.
-показатель адиабаты.
Обработка результатов опыта
Таблица 1.
| № опыта | t, с | L1, см | L2, см | h1t, см | 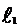 ,
см ,
см
| 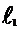 , см , см
| h2t, см | 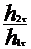
| 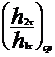
| ln 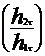
| 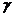
|
| 16, 44 16, 25 15, 20 | 38, 73 39, 21 40, 15 | 22, 29 22, 96 24, 95 | 24, 90 23, 85 22, 75 | 30, 36 29, 22 28, 58 | 5, 46 5, 37 5, 83 | 0, 245 0, 232 0, 234 | 0, 237 | -1, 441 | |||
| 15, 89 14, 75 15, 34 | 39, 51 40, 32 40, 00 | 23, 62 25, 57 25, 66 | 25, 48 25, 35 25, 39 | 30, 90 30, 80 30, 81 | 5, 42 5, 45 5, 42 | 0, 229 0, 213 0, 211 | 0, 218 | -1, 523 | |||
| 17, 43 14, 85 15, 90 | 37, 85 40, 37 39, 38 | 20, 42 25, 52 23, 48 | 26, 18 25, 50 25, 53 | 30, 25 30, 70 30, 75 | 4, 07 5, 20 5, 22 | 0, 199 0, 204 0, 204 | 0, 202 | -1, 599 | |||
| 16, 40 16, 43 16, 34 | 38, 80 38, 90 38, 98 | 22, 40 22, 47 22, 64 | 26, 00 26, 10 25, 89 | 30, 30 30, 29 30, 46 | 4, 30 4, 19 4, 57 | 0, 192 0, 186 0, 201 | 0, 193 | -1, 645 | |||
| 16, 35 16, 75 15, 45 | 38, 88 38, 62 39, 75 | 22, 53 21, 87 24, 30 | 26, 10 26, 30 26, 00 | 30, 35 30, 15 30, 26 | 4, 25 3, 85 4, 26 | 0, 187 0, 176 0, 175 | 0, 179 | -1, 720 |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|