
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ЕН.01 Химия. Теоретические основы
ЕН.01 Химия
Тема: Решение задач на газовые законы.
Цель: получить практические навыки применения газовых законов для решения химических задач.
Теоретические основы
Закон Авогадро
В равныхобъёмах любых газов, взятых при одной и той же температуре и при одном и том же давлении, содержится одно и то же число молекул.
Следствие из закона:
1 моль (6,02×1023 молекул – число Авогадро) любого газа при нормальных условиях занимает объем 22,4 л. Эта величина называется молярный объём.
Vm = 22,4 л,
Нормальными условиями (н.у.) считают температуру 0оС (273 K) и давление 1 атм (760 мм ртутного столба или 101 325 Па).
Пример.
Определить число молекул, содержащихся в воде количеством 0,5 моль.
N(H2O) = NA·× ν(H2O) = 6,02·× 1023 моль-1·× 0,5 моль = 3,01·× 1023.
Молекулярная масса Mr – отношение массы молекулы к 1/12 части массы атома углерода С.
Молярная масса M – отношение массы вещества m к его количеству ν, выражается в единицах г/моль.
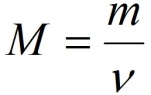 ,
,
Из закона Авогадро следует, что массы двух газов (m1 и m2), взятых в одинаковых объёмах, должны относится друг к другу, как их как их молекулярные массы или как численно равные их молярные массы (M1 и M2):
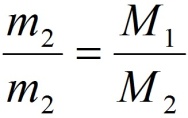 .
.
Отношение массы одного газа к массе другого газа, взятого при тех же условиях (температуре и давлении), называется относительной плотностью первого газа по второму.
 ,
,
откуда
М1=DM2.
Молярная масса вещества (M), а значит, и относительная молекулярная масса (Mr) вещества в газообразном состоянии, численно равна удвоенной плотности паров этого вещества по водороду.
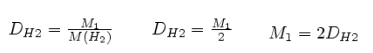
Измерения объемов газов обычно производят при условиях, отличных от нормальных.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|