
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
где =КБ – постоянная Больцмана
DS ³ 0
Самопроизвольные процессы всегда связаны с ростом числа микросостояний – ω – системы. В этих же процессах происходит возрастание энтропии – S – системы. Т. е. энтропия возрастает с увеличением числа микросостояний системы. Впервые на это обратил внимание австрийский химик Больцман, который в 1872 году предложил уравнение:
S = 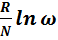 ,
,
где =КБ – постоянная Больцмана
КБ = 1,38 ∙ 10-23Дж/К
Формула Больцмана позволяет теоретически рассчитать энтропию системы по числу возможных ее микросостояний. Таким образом могут быть определены абсолютные значения энтропии кристаллов. Увеличение числа микросостояний системы связано с ростом неупорядочности системы (два слоя упорядоченная система; один слой – неупорядоченная система). Поэтому молекулярно-кинетическое определение энтропии:
Энтропия – есть мера вероятности пребывания системы в данном состоянии или мера неупорядоченности системы.
Важное значение понятия энтропии связано с тем, что на основе этой величины можно прогнозировать направление самопроизвольного протекания процессов, согласно П началу термодинамики.
Энтропия по своему значению может иметь абсолютное и относительное значения. Абсолютное – когда нет движения. Энтропия идеального кристалла у алмаза = 0 (Ш начало термодинамики). За «0» принята энтропия протона водорода (относительная энтропия).
So 298о К (Н+)
Н2 = 32 – это значит, что система имеет ω = 1010 – 1025 микросостояний хаотичности. Энтропия меняется от фазового состояния. Энтропия жидких систем больше, чем газообразных. Чем меньше энтропия, тем тверже вещество. У алмаза S = 0,56 (таблица Менделеева – энтропия увеличивается в группах).
Второй закон термодинамики:
В изолированных системах самопроизвольно протекают процессы в сторону увеличения энтропии (DS > 0).
Используя первый закон термодинамики, нельзя определить направление течения самопроизвольного процесса при данных условиях.
Физический смысл энтропии
1. Если система изолирована, при протекании в ней обратимых процессов энтропия не изменяется. При обратимых процессах – растет, т.е. энтропия является критерием самопроизвольных процессов в изолированных системах.
2. Увеличение энтропии связано с усилением хаотического движения молекул, т.е. рост энтропии связан с увеличением неупорядоченности в системах. Т.е. энтропия – мера беспорядка в системе.
Термодинамический потенциал характеризует стремление системы достигнуть минимума энергии.
G - термодинамический потенциал
DG = - Amax – изобарно-изотермический потенциал или свободная энергия Гиббса
G – свободная энергия – системы валюты, расплачивания с окружающей средой. Система находится в балансе. Энтальпия Н – величина увеличения запаса энергии. S – энтропия – на разрушение.
G – энергия Гиббса, вводится в качестве критерия самопроизвольности процессов в открытых и закрытых системах. Эта функция получила название в честь американского ученого Гиббса, который вывел эту функцию и применил в термодинамических расчетах.
На основании уравнения Гиббса второе начало термодинамики можно сформулировать следующим образом:
В изобарно-изотермических условиях (р, Т – const.) в системе самопроизвольно могут осуществляться только такие процессы, в результате которых энергия Гиббса системы уменьшается (DG < 0). В состоянии равновесия энергия Гиббса системы не меняется (DG = 0); DG > 0 – процесс не протекает (G – const.); DG ≤ 0 (р, Т – const.).
а) DG = DН – ТDS – изобарно-изотермический потенциал
Свободная энергия Гиббса. Она является мерой устойчивости системы при постоянном давлении.
При условии постоянства объема состояние системы может быть описано аналогичной характеристической функцией, которая называется свободной энергий Гельмгольца:
DF = DU – ТDS – изохорно-изотермический потенциал
Соотношение междуDG и DF такое же, как между DН и DU, т.е. они различаются на величину работы расширения.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|