
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Металдардың жалпы сипаттамасы
МЕТАЛТАНУ ЖНЕ ТЕРМИЯЛЫҚ ӨҢДЕУ
ЛЕКЦИЯ 1
Крспе
Металтану – металдар және қорытпалардың құрамы мен олардың қасиеттерінің арасындағы байланысты және олардың сыртқы факторлардың (жылулық, химиялық, электрмагниттік және радиоактивтік) әсерінен өзгеру заңдылықтарын зерттейтін ғылым.
Алғаш рет болаттың құрылысы мен қасиеттерінің арасындағы байланыс барын П.П.Аносов ашқан (1799-1951жж., 1834 ж. металдардың құрылысын зерттеуде микроскопты пайдаланған).
1868 ж. Д.К.Чернов болатта қатты күйінде белгілі температураға дейін қыздырғанда (суытқанда) оның қасиеттерін күрт өзгертетін фазалық өзгерістер болатынын көрсетті.
Металтанудың дамуына металдарды зерттеуде физика-химиялық әдістерді қолданған Н.С.Курнаковтың еңбектері зор ықпал жасады.
Барлық металдар мен қорытпаларды екі топқа бөліге болады: қара және түсті.
Темір және оның негізіндегі қорытпаларды (болат, шойын) қара металдарға, ал басқа металдар мет қорытпаларды түсті деп атайды.
Қара металдар кең қоланыс тапқан. Темірдің негізінде барлық конструкциялық және саймандық материалдардың 90% жасалады. Түсті металдарға қарағанда темірдің және оның қорытпаларының бағасы төмен. Түсті металдар қасиеттері бойынша жеңіл (Be,Mg,Al,Ti); жеңіл балқитын (Zn,Cd, Sn, Sb, Hg, Pb, Bi); қиынбалқитын (Ti, Cr, Zr, Nb, Mo, W, V ж.б.), балқу температурасы темірдікінен жоғары; асыл (Rh, Pd, Ag, Os, Pt, Au ж.б.), урандық металдар (U, Th, Pa) – актиноидтар, атом техникасында пайдаланатын; сирекжер металдар (РЗМ), лантаноидтар (Ce, Pr, Nd, Sm ж.б.) және оларға ұқсас , әртүрлі қортпаларға түртпе ретінде қоланылатын иттрий мен скандий; сілтілік металдар (Li, Na, K), атомдық реакторларда жылу тасымалдағыш ретінде пайдаланылады.
1 МЕТАЛДАРДЫҢ КРИСТАЛДЫҚ ҚҰРЫЛЫСЫ
1.1 Металдардың жалпы сипаттамасы
Қазіргі кезде белгілі 109 элементтің 76 металдар. Қатты және кейде сұйық күйінде металдардың өзіндік қасиеттері бар:
1) жоғары жылу- және электрөткізгіштік;
2) электркедергісінің температуралық коэффициенті оң, температураны көтергенде таза металдардың электр кедергісі артады;
3) термоэлектрондық эмиссия, яғни қыздырғанда электрондар шығару қабылеттілігі;
4) жақсы шағылыстырғыштық қабылеттілігі. Металдар мөлдір емес, металдық жарқылы бар;
5) пластикалық деформацияға қабылеттілігі жоғары.
Осы қасиеттер заттың металдық күйін сипаттайды.
Барлық металдар мен металдық қорытпалар – кристалдық денелер, атомдар (иондар) металдарда белгілі заңдылықпен орналасқан.
Металдар көп кеңістікте кездейсоқ бағытталған ұсақ (10-1 – 10-5 см) кристалдардан тұрады. Кристалдану жағдайына байланысты оларды пішіні дұрыс емес, оларды кристаллиттер немесе түйіршіктер деп атайды.
Металдардың барлық өзіне тән қасиеттері оларда еркін қозғалатын ортақ өткізу электрондарының болуымен түсіндіріледі.
Металл атомдарының сыртқы энергетикалық деңгейінде ядромен байланысы әлсіз аздаған электрондар бар, олар салыстырмалы бос жағдайда болады да электрондық газ түзеді.
Атомдар бірлестігінде металдық күй жеке атомдар бір-бірімен жақындасқанда сыртқы электрондардың байланысы үзіліп ортақ болуының нәтижесінде, яғни периодты орналасқан атомдардың арасында еркін қозғалуының нәтижесінде түзіледі.
Металдарда металдық байланыс күші тондар мен электрондардың арасындағы тарту және тебу күштері арқылы айқындалады және бағытталған емес. Атомдар (иондар) бір-бірімен олардың әрекеттесу энергиясы минималды болатын қашықтықта орналасады (1-ші сурет).

1-ші сурет. Атомаралық қашықтыққа байланысты екі атомның әрекеттесу күштері.
Атомдардың (иондардың) а0 қашықтықтан кем жақындату немесе одан артық қашықтыққа аластату тек тарту және тебу күштеріне қарсы жұмыс жүргізенде ғана мүмкін болады. Осыған байланысты металдарда атомдар, дұрыс кристалдық тор құрып, белгілі заңдылықпен орналасады, атомдардың әрекеттесу энергиясының минималды шамасында.
Металдық күй атомдардың арасындағы байланыс энергиясының жоғары деңгейімен сипатталады. Оның өлшемі сублимация жылуы, ол қатты күйден бу күйіне өткізуге қажетті энергияның мөлшері. Металдар үшін сублимация жылуы 84 тен 920 кДж/(г-атом) дейінгі шекте өзгереді.
Металдардың жоғары электрөткізгіштігі оларда бос электрондардың еркін қозғалуымен және атомдардың тербелістік қозғалысының аздаған дәрежесімен түсіндріледі.
Металдардың жоғары пластикалығы атомдық құрылымының периодтылығымен және металдық байланыстың бағытталмауымен түсіндіріледі. Пластикалық деформация кезінде иондардың (атомдардың) арасындағы байланыс бұзылмайды.
Таза металдардың беріктігі төмен және қажетті қасиеттерді қамтамасыз ете алмайды, сондықтан сирек қолданылады. Ең көп қолданылатыны қорытпалар. Қорытпаларды екі немесе одан көп металдарды немесе металдарды металеместермен балқыту немесе үнтақтарды күйежентектеу арқылы алады. Қорытпаны құрайтын химиялық элементтер компоненттер деп аталады. Қорытпа екі немесе одан көп компоненттен тұруыф мүмкін.
Металтануда жүйе (система) фаза, құрылыс деген ұғымдар кең қолданылады. Жүйе деп тепе-теңдік жағдайдағы фазалардың жиынтығын айтады. Фаза деп жүйенің химиялық және физикалық тұрғыдан біртекті, шекара бетімен шектелген бөлігін атайды. Құрылыс деген ұғым металдар немесе қорытпаларда фазалардың өлшемдерін және өзара орналасуын сипаттайды.
Қорытпаның құрылыстық құрастырушылары деп жүйенің, өздеріне тән бірдей құрылысы бар, жекеленген бөлігін айтады.
Макроқұрылыс және микроқұрылыс деп бөлінеді.
1.2 Металдардың атомдық-кристалдық құрылысы
Атомдық-кристалдық құрылыс деп кристалдағы атомдардың өзара орналасуын айтады. Кристалл белгілі ретпен орналасқан және үш өлшемде қайталанатын атомдардан (иондардан) тұрады.
Атомдық-кристалдық құрылысты сипаттау үшін кеңістіктік немесе кристалдық тор деген ұғымды қолданады.
Кристалдық тор деп шартты түрде, түйіндерінде атомдар (иондар) орналасқан кеңістктегі торды айтады (2-ші сурет).
Кристалдық тордың симметриясын, атомдардың орнасу ретін, тығыздығын, т.б. қасиеттерін сипаттайтын ең кіші бөлігін элементар тор немесе торұя деп атайды.
Элментар торды үш бағытта үздіксіз тасымалдау арқылы тұтас кристалдық тор құрғызуға болады.
Кеңістіктік торлар осьтік бірліктер және бұрыштарының қатынастары бойынша жеті жүйеге бөлінеді – сингонияларға.
1) триклиндік а ≠ в ≠ с, α ≠ β ≠ γ ≠ 900;
2) моноклиндік а ≠ в ≠ с, α = γ= 900, β ≠ 900;
3) ромбиялық а ≠ в ≠ с, α = β = γ = 900;
4) гексагональды а = в ≠ с, α = β = 900 γ = 1200;
5) ромбоэдрикалық а = в = с, α = β = γ ≠ 900;
6) тетрагональды а = в ≠ с, α = β = γ = 900;
7) кубтық а = в = с, α = β = γ = 900.
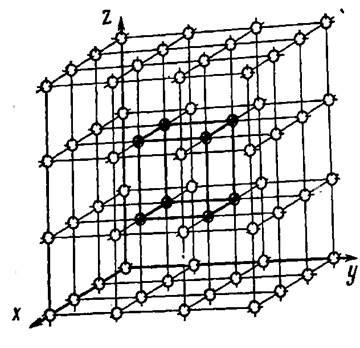
2-ші сурет. Кристалдық тор.
Элементар торға бір атом келетін кристалдық торларды қарапайым деп атайды. Элементар торға бірнеше атом келетін торларды күрделі деп атайды. Металдар атомдардың тығыз орналасуына байланысты келесі түрге бөлінеді: көлемдік центрлеген куб (КЦК), беттік центрленген куб (БЦК) және гексогональды тығыз топ (ГТТ).
КЦК торда (3,а сурет) атомдар торұяның түйіндерінде, ал бір атом кубтың центрінде орналасқан. КЦК торларына келесі металдар ие: Rb, K, Na, Li, Tiβ, Tlβ, Zrβ, Ta, W, V, Fe, Cr, Nb, Ba т.б.
БЦК торда атомдар кубтың түйіндерінде және әр беттің ортасында орналасқан (3,б сурет). Мұндай торға ие металдар: Са, Се, Sr, Th, Pb, Sc, Ni, Ag, Au, Pd, Pt, Rh, Ir, Feγ, Cu, Coα т.б.
ГТТ атомдар (3,в сурет) атомдар алты бүйірлі призманың түйіндерінде және астыңғы және үстіңгі бетінің центрінде, және үш атом призманың ортаңғы жазықтығында орналасқан. Мұндай торды иеленетін металдар: Hf, Mg, Tiα, Cd, Re, Os, Ru, Zn, Coβ, Be, Caα, Laα, Tlα, Zrα и др.
 3-ші сурет. Металдардың кристалдық торлары және атомдардың орналасу сұлбасы:
3-ші сурет. Металдардың кристалдық торлары және атомдардың орналасу сұлбасы:
а –көлемдік центрленген куб (к.ц.к.); б – беттік центрленген куб (б.ц.к.); в – гексагональды тығыз топтама (г.т.т.)
Кристалдық тордың өлшемдері период мөлшерімен сипатталады, ол элементар ұяшық құрайтын ең жақын параллель атомдық жазықтықтардың арасындағы қашықтық. Тордың периоды ангстреммен (1Ǻ =10-8 см) немесе килоикспен (1 кХ = 1,00202·10-8 см) өлшенеді. Металдардың торларының периоды 1-7Ǻ аралығында болады.
КЦК торында 1 элементар ұяшыққа екі атом келеді: бір атом кубтың центрінде ал екінші атомды кібтың түйіндерінде орналасқан атомдар енгізеді (1/8·8 =1 атом).
БЦК торының элементар ұяшығына төрт атом келеді (1/8·8 + 1/2·6=4).
ГТТ элементар ұяшығына алты атом келеді (3+1/6·12+1/2·2=6).
Кристалдық тордың тығыздығы, яғни шартты түрде қатты шарлар деп қарастырылған атомдардың алатын көлемін координациялық сан сипаттайды, ол кез келген жеке атомның төңірегінде бірдей қашықтықта орналасқан көрші атомдардың саны.
Координациялық сан неғұрлым үлкен болса, соғұрлым атомдардың топтасу тығыздығы жоғары болады.
КЦК элементер ұяшығында атомдардың арасындағы минималды қашықтық d = (a  )/2.
)/2.
Осы қашықтықта берілген атомның (А) 8 көршісі бар (4,а сурет). Бұл тордың координациялық саны 8 және К8 деп белгіленеді. Ұяшықты толтыру коэффициенті, атомдар тортылған көлемнің ұяшықтың көлеміне қатынасы 68%.

4-ші сурет. Берілген атомнан А тең немесе ең жақын қашықтықта орналасқан атомдардың санын көрсететін сұлба: а – К8; б – К12; в – Г12.
БЦК торы үшін кординациялық сан 12 (К12) (4,б сурет), әр атомның d = (а  )/2 қашықтықта 12 көршісі бар. ГТТ торында да координациялық сан 12 тең (Г12) (4,в сурет), атомдармен көлемді толтыру коэффициенті 74%.
)/2 қашықтықта 12 көршісі бар. ГТТ торында да координациялық сан 12 тең (Г12) (4,в сурет), атомдармен көлемді толтыру коэффициенті 74%.
Атомдық жазықтықтарды кристаллографиялық белгілеу.Кристалдық торлардағы атомдық жазықтықтарды (атомдар арқылы өтетін) белгілеу үшін h,k,l индекстерін қолданады, олар осы жазықтықтың координаттар осінде қиятын шамалардың кері рационалды үш бүтін саны. Осьтер бойында ұзындық бірлігін элементар ұяшықтың бүйірінің ұзындығына тең етіп алады.
Жазықтықтарды белгілеу мысалдары. Кубтың жазықтығы үшін индекстер. Кубтың әр жазықтығы (5,а сурет) тек бір осьті қияды, сонда кескінде келесідей болады (1,∞,∞) (∞,1∞) (∞,∞,1). Кескіндердің кері шамалары сәйкесінше 1,0,0; 0,1,0; 0,0,1 болады.Жазықтықтың индекстерін h,k,l әдетте жақшаға алып жазады (100), (010), (001).
Кубтық торда тағы да октаэдр (111) (5,б сурет) және ромбтық додекаэдр (110) (5,в сурет) жазықтықтары да бар.
Бағыттардың индекстері. Бағыттың индестері квадрат жақшаға алынған [uvw], осы бағыттың және барлық параллель бағыттардың индексі. Тор осьтерінің индекстері: x – [100], y – [010] және z – [001]. Көлемдік диагональ индексі [111]. Кубтық тор үшін (h,k,l) жазықтығына перпендикуляр бағыттардың индекстері [uvw] сан жағынан осы жазықтықтың индексіне тең болады. Мысалы, x осьінің индексі [100], ал x-ке перпендикуляр жазықтықтың индексі де (100) болады.
Металдардың қасиеттерінің анизотропиясы. Лі жазықтықтарда атомдардың орналасу тығыздықтары әртүрлі екенін көреміз. Мысалы, КЦК тордың (100) жасзықтығының үлесіне бір атом келеді (1/4х4), ромбылық додекаэдр жазықтығына (110) екі атом: бір атомды кубтың төбелеріндегі, ал екінші атомды центріндегі атом береді. БЦК торда атомдар твғвз орналасқан жазықтық октаэдр (111), ал КЦК торда (110) жазықтық.
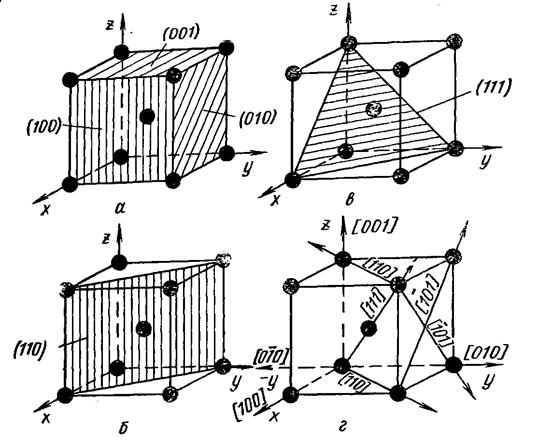
5-ші сурет. К.Ц.К. торында кристаллографиялық жазықтықтар мен бағыттардың индекстері.
Торда әртүрлі бағыттар мен жазықтықтарда атомдардың тығыздығы әртүрлі болғандықтан кристалдың көптеген қасиеттері де (химиялық, физикалық, механикалық) әртүрлі болады. Кристалдың қасиеттерінің әртүрлі кристаллографиялық бағыттарда әртүрлілігін анизотропия деп атайды.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|