- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
ХИМИЯ. ГАЗОВЫЕ ЗАКОНЫ
ХИМИЯ. ГАЗОВЫЕ ЗАКОНЫ
Поведение идеальных газов описывают следующие законы:
1) при постоянной температуре изменение объема газа обратно пропорционально изменению давления (закон Бойля - Мариотта);
2) при постоянном давлении изменение объема газа прямо пропорционально изменению абсолютной температуры (закон Шарля - Гей-Люссака);
3) при постоянных температуре и давлении изменение объема прямо пропорционально изменению количества вещества (закон Авогадро).
Эти законы можно представить в виде одного уравнения состояния идеального газа PV = nRT (уравнение менделеева-клапейронаэтотоже самоеPV=m/M*RT), где Р - давление газа (Па), V - его объем (м3), Т - абсолютная температура (К), n - число молей газа, R - универсальная газовая постоянная, равная 8,314 Дж/K*моль (R = 0,08206 л*атм/К*моль, если P измеряют в атмосферах, V - в литрах, n - в молях, T - в кельвинах).
Если два газа смешать при постоянных температуре и давлении, то объем смеси будет равен сумме объемов газов, ее составляющих; при постоянном объеме давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь (закон парциальных давлений, установленный Дальтоном).
Парциальное давление- это давление компонента идеальной газовой смеси, которое он оказывал бы, если бы один занимал объем всей смеси. Мольная доля одного из компонентов газовой смеси - это та часть всех молекул газа, которую составляют молекулы данного компонента. Для любого газа в смеси
 <="" div="">
<="" div="">
Газы,поведение которых строго следует приведенному выше общему уравнению,называются идеальными. К ним близки инертные и другие газы, имеющие очень низкую температуру кипения (например, водород, кислород и азот). Газы с высокой температурой кипения, такие, как диоксид углерода, подчиняются законам идеальных газов весьма приближенно.
Представленные выше газовые законы основываются на допущении, что молекулы (или атомы) газа не имеют объема и не взаимодействуют друг с другом. Если газ заключить в замкнутый сосуд, то его давление будет определяться энергией молекул, бомбардирующих стенки.
Между числом молекул и объемом газа существует следующее количественное соотношение: один моль любого газа содержит 6,022*10 23 молекул и при нормальных условиях (0° С и 760 мм рт. ст.) занимает объем 22,4 л (см. АВОГАДРО ЧИСЛО).
Относительная плотность газа – это сравнение молярной или относительной молекулярной массы одного газа с аналогичным показателем другого газа:
M1
D = ——
M2
Обычно плотность газов определяют по отношению к водороду как самому легкому газу. Часто газы сравнивают также с воздухом.
Чтобы показать, с каким газом сравнивают исследуемый газ, к символу относительной плотности добавляют индекс. Затем в скобках пишут исследуемый газ.
Если, к примеру, плотность оксида серы SO2 рассчитывают по водороду, то это пишется так: DH2(SO2).
Читается так: плотность оксида серы по водороду.
Пример:
Рассчитаем плотность хлора по водороду.
Пользуясь Периодической таблицей, определяем молярные массы хлора и водорода:
M(Cl2) = 71 г/моль
M(H2) = 2 г/моль
Соответственно:
M(Cl2) 71
DH2(Cl2) = ———— = —— = 35,5
M(H2) 2
Примеры задач:
1) Какой объем (н.у.) займут 0,4•10-3 м3 газа, находящегося при 50оС и давлении 0,954•105Па?
| Дано V = 0,4•10-3 м3 t = 50oC; T=323 К P=0,954•105Па V0 - ? | Решение Для приведения объема газа к н.у. используем 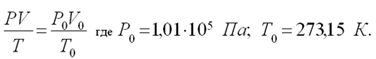
|
Отсюда 
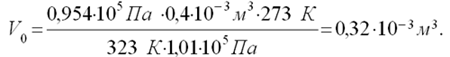
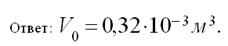
2)Масса 0,327•10-3 м3 газа, при 13оС и давлении 1,04•105Па равна 0,828•10-3 кг. Вычислить молярную массу газа.
| Дано: V = 0,4•10-3 м3 t = 50oC; T=323 К P=0,954•105Па | Решение: Для решения задачи применим уравнение Клапейрона – Менделеева
|
| V - ? |
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|