
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Содержание 2 страница
Природные процессы индукции[править | править код]
Ещё в 1895 году Томас Морган, удалив один из двух бластомеров лягушки, обнаружил, что оставшаяся часть эмбриона способна, тем не менее, воссоздать цельный эмбрион. Это означало, что клетки, при необходимости, способны изменять направление своей специализации и такое изменение скоординировано. Позднее в 1924 году, Шпеманн и Мангольд (Spemann and Mangold) показали, что важнейшую ключевую роль в процессах развития животных играют межклеточные взаимодействия называемые индукцией[24]. Метаплазией называют обратимую замену одного дифференцированного типа клеток на другой тип зрелых дифференцированных клеток[25]. Этот переход от одного типа клеток к другому может быть частью нормального процесса созревания или вызван каким-то индуцирующим его стимулом. Примерами этого перехода можно назвать трансформацию клеток радужной оболочки глаза в линзу в процессе созревания и превращение клеток пигментного эпителия сетчатки в нейральную сетчатку при регенерации глаза у взрослых тритонов. Этот процесс позволяет организму заменить исходные клетки, не подходящие к новым условиям, на новые которые больше подходят к новым условиям. В опытах на клетках имагинальных дисков дрозофилы было обнаружено, что существует ограниченное число стандартных дискретных состояний дифференцировки и клеткам приходится выбирать одно из них. Тот факт, что трансдетерминация (смена пути дифференцировки) часто происходит не в одной, а сразу в группе клеток доказывает, что она вызвана не мутацией, а именно индуцирована[26][27].
К настоящему времени удалось выявить минимальные условия и факторы, наличия которых достаточно для индукции каскада молекулярных и клеточных процессов, направляющих дифференцировку и самоорганизацию плюрипотентных клеток в эмбрион. Роль морфогенов, как оказалось, выполняют противоположно направленные градиенты концентрации морфогенетического белка костной ткани (BMP) и белка Nodal[en][28].
Некоторые типы зрелых, специализированных клеток взрослого организма способны естественным путём вернуться к стадии стволовой клетки[29]. Например, дифференцированные клетки желудка, называющиеся аделоморфными или «главными клетками» и синтезирующие маркер стволовых клеток Troy, обычно производят пищеварительные жидкости. Однако, они могут при необходимости превратиться обратно в стволовые клетки для «ремонтных работ» в случае травм желудка, таких как порез или повреждение вызванное инфекцией. Более того, они осуществляют этот переход даже в отсутствие заметных травм и способны восполнить пул всех клеточных линий желудочного эпителия, по существу, выступая в качестве покоящихся «резервных» стволовых клеток[30]. При повреждении трахеи, дифференцированные эпителиальные клетки дыхательных путей могут вернуться к фенотипу стабильных и функциональных стволовых клеток, если, однако, они не имеют непосредственного контакта с базальной стволовой клеткой, которая предотвращает подобную дедифференцировку[31]. Зрелые терминально дифференцированные эпителиальные клетки почки, после травмы, способны дедифференцироваться в свои более ранние версии, а затем снова дифференцироваться в типы клеток нуждавшихся в замене в поврежденной ткани[32]. Макрофаги могут самообновляться путём локальной пролиферации зрелых дифференцированных клеток[33]. Это происходит, когда понижаются концентрации или происходит ингибирование двух факторов транскрипции MafB и c-Maf, препятствующих активации программы самообновления[34]. У тритонов мышечная ткань восстанавливается из специализированных мышечных клеток, которые для этого дедифференцируются забыв свою прежнюю специализацию. Эта способность к регенерации тканей не уменьшается с возрастом, что вероятно связано со способностью тритонов при необходимости образовывать из мышечных клеток новые стволовые клетки[35].
Следует отметить, что в организме существует небольшой процент стволовых клеток, способных генерировать множество различных типов клеток. Например, мультилинейно-дифференцирующиеся устойчивые к стрессу (англ. muse cell) стволовые клетки взрослого человека обладают способностью к самообновлению и образуют в суспензионной культуре характерные скопления (кластеры) плюрипотентных клеток, которые могут дифференцироваться как in vitro, так и in vivo в энтодермальные, эктодермальные и мезодермальные клетки[36][37][38][39][40][41]. Они также легко перепрограммируются в ИПСК[42][43].
Подробное описание некоторых других хорошо документированных примеров трансдифференцировки[en] in vivo и их роль в развитии и регенерации рассматриваются в обзоре[44][45].
Индуцированные тотипотентные клетки (иТК)[править | править код]
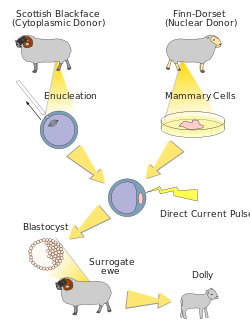
Схема клонирования Долли
Перепрограммирование в иТК с помощью SCNT[править | править код]
Индуцированные тотипотентные клетки обычно используют для клонирования[46] и получения генетически модифицированных животных[47]. Эти клетки можно получить с помощью перепрограммирования соматических клеток путём переноса ядер соматических клеток (Somatic cell nuclear transfer — SCNT) в ооциты-реципиенты[1][48][49][50][51][52]. При этом ооциты не обязательно должны принадлежать тому же виду. Иногда удается использовать ооциты других видов, например овец[53] или поросят[54]. И хотя эффективность межвидовой SCNT была примерно в три раза ниже обычной, такие эмбрионы удавалось довести до стадии бластоцисты[54]. Эффективность перепрограммирования можно повысить в два раза, если за сутки до пересадки остановить мейоз ооцитов-реципиентов с помощью бутиролактона1 в комбинации с нейротрофическим фактором мозга (BDNF)[55]. Кроме того, эффективность клонирования может быть значительно повышена, а процедура SCNT упрощена благодаря использованию ингибиторов гистондеацетилазы, таких как трихостатин А[56] и ингибиторов полимеризации цитоскелетного актина таких как цитохалазин В или латранкулин A (latrunculin A)[57]. Для полноценного развития образующихся эмбрионов необходимо также предварительно уменьшить метилирование лизина 4 в молекуле гистона H3 в клетках донорах ядра[58]. Кроме того для полноценного развития эмбриона необходимы также экзосомы выделяемые его клетками.[59]
Повторное клонирование на протяжении 25 поколений жизнеспособных мышей с помощью метода SCNT, основанном на добавлении в среду клеточной культуры ингибитора деацетилазы гистонов — трихостатина А,[56] показало, что можно достаточно долго (на протяжении 16 лет) неоднократно повторно клонировать животных без видимого накопления нарушений в геноме[60].
До настоящего времени бытует представление о возможности преждевременного старения клонированных животных, полученных методом SCNT. Показано, что теломеры у эмбрионов клонированных свиней, полученных с помощью стандартных методов SCNT хуже восстановлены, по сравнению с эмбрионами образующимися по естественному пути. Обработка же трихостатином А значительно увеличивает длину теломер у клонированных свиней и это может быть одним из механизмов, лежащих в основе улучшенного развития клонированных животных, после обработки трихостатином А[61].
При использовании технологии SCNT разработанной Миталиповым[1] можно получать ЭСК человека используя ядра из фибробластов кожи даже пожилых людей, что открывает широкие перспективы для технологий регенеративной медицины[62][63][64]
Разработан метод, открывающий новые возможности для создания генетически модифицированных животных с помощью гаплоидных эмбриональных стволовых клеток, которые могут быть использованы вместо спермы. Для этого из ооцита удаляют ядро. Затем в него вводят микроинъекцией сперму. Из образующейся в результате этого бластоцисты получают гаплоидные эмбриональные стволовые клетки. Эти клетки, синхронизованные в М фазе, вводят в ооцит вместо спермы, в результате чего развивается жизнеспособное потомство[65]. Эти разработки, вместе с данными о возможности неограниченного получения ооцитов из митотически активных половых стволовых клеток[66], открывают возможность промышленного производства трансгенных сельскохозяйственных животных. Так, в Китае с помощью упрощенной техники клонирования получены трансгенные овцы, у которых улучшено качество мяса и молока за счет увеличения в них незаменимых ненасыщенных жирных кислот, которые снижают риск развития ишемической болезни сердца и необходимы для поддержки глаз и головного мозга. Ген, вызывающий синтез ω-3 полиненасыщенных жирных кислот успешно удалось передать трансгенной овце. Клонирование животных для исследовательских целей в Китае уже приобрело промышленные масштабы. Одних только различных клонов поросят производится порядка 500[67].
Подобные технологии могут также найти клиническое применения для преодоления цитоплазматических дефектов в ооцитах человека[68]. Например, разработаны технологии, которые могут воспрепятствовать нежелательному наследованию митохондриального заболевания, которое передается следующему поколению. Митохондрии, которые часто называют «электростанцией клетки», содержат генетический материал, который передается от матери к ребёнку. Мутации митохондриальной ДНК могут вызвать диабет, глухоту, заболевания глаз, желудочно-кишечные расстройства, болезни сердца, деменцию и ряд других неврологических заболеваний. Пересадкой ядра из яйцеклетки одного человека (несущей дефектную митохондриальную ДНК) в другую (здоровую) можно эффективно заменить цитоплазму клетки и вместе с ней митохондрии (и их ДНК)[69]. Полученная таким образом яйцеклетка может рассматриваться как имеющая двух матерей. Эмбрион образующийся после оплодотворения такой яйцеклетки будет иметь здоровую митохондриальную ДНК[70]. Однако насколько оправданы подобные манипуляции с клетками человека с точки зрения биоэтики пока не ясно[71].
Подробнее о новейших достижениях техники клонирования и получении тотипотентных клеток с помощью SCNT см.:[72][73]
Перепрограммирование в иТК без помощи SCNT[править | править код]
До недавнего времени получить тотипотентные клетки удавалось лишь с помощью SCNT. Однако появились работы где было продемонстрировано получение иТК с помощью перепрограммирования факторами Яманаки in vivo[74][75], а также in vitro с помощью таких эпигенетических факторов ооцита как зародышевая изоформа гистонов[76]. Перевести эмбриональные стволовые клетки в состояние тотипотентности характерное для ранних эмбрионов 2-клеточной стадии можно также путём подавления активности CAF-1 необходимой для сборки хроматина[77]. От превращения ЭСК и ИПСК в тотипотентные клетки, способные дать начало таким внеэмбриональным тканям как плацента и желточный мешок, плюрипотентные стволовые клетки, по-видимому, так же удерживает микроРНК-34а[78]. Ингибирование её синтеза приводит к активации экспрессии эндогенного ретровируса MuERV-L и расширяет потенциал плюрипотентных стволовых клеток до способностей клеток стадии двух бластомеров[79].
Разработан химический коктейль для получения так называемых плюрипотентных стволовых клеток с расширенными возможностями по дифференцировке — они могут дать начало как клеткам эмбриона, так и внеэмбриональным тканям. Такие супертотипотентные клетки (иСТК) могут быть использованы для получения химер с целью выращивания органов в организме животных[80][81]
Получение репродуктивных клеток из ИПСК[править | править код]
Используя среды, содержащие ретиноевую кислоту и фолликулярную жидкость свиньи, можно получить in vitro, дифференцировкой из ИПСК, клетки ранних стадий гаметогенеза подобные репродуктивным клеткам, из которых образуются сперма и ооциты[82][83][84]. Примечательно, что для образования примордиальных половых клеток человека требуется активность двух ключевых регуляторов: гена SOX17 направляющего дифференцировку в сторону образования предшественников половых клеток и Blimp1 подавляющего энтодермальные и другие соматические гены во время этой специализации[85].
В статье китайских ученых с первым автором Чжоу (Zhou) описана технология дифференциации мышиных эмбриональных стволовых клеток которые претерпевают мейоз in vitro превращаясь в гаплоидные сперматиды, способные к оплодотворению, о чём свидетельствовало получение с их помощью жизнеспособного и фертильного потомства[86][87].
Подробный обзор методов искусственного получения мужских половых клеток можно найти в статье Hou с соавт.[88] и Irie, Kim, Surani[89]
Разработана технология позволяющая получать зрелые ооциты in vitro из эмбриональных стволовых клеток, а также из индуцированных плюрипотентных стволовых клеток, полученных из взрослых фибробластов взятых с кончика мышиного хвоста. Более того оплодотворив такие яйцеклетки in vitro и подсадив их в матку мыши удалось с выходом в 1 % получить жизнеспособное потомство[90][91][92]. Эта технология послужит платформой для выяснения молекулярных механизмов, лежащих в основе тотипотентности и для разработки методов производства ооцитов из других (в том числе редких) видов млекопитающих в лабораторных условиях.
ИПСК как результат радикального омоложения[править | править код]
Основная статья: en:Induced pluripotent stem cells
Если поместить клетки тератокарциномы в ранний зародыш млекопитающего (на стадии бластоцисты), то они включаются в состав клеточной массы бластоцисты и из такого химерного (то есть состоящего из клеток от разных организмов) эмбриона нередко развивается нормальное химерное животное. Почти во всех органах и тканях таких животных часть дифференцированных клеток происходит из клеток тератокарциномы, которые совместно с клетками нормального происхождения участвуют в построении здорового организма. Аналогичная трансплантация клеток тератокарциномы во взрослый организм неизменно приводит к развитию тератокарциномы.
Впервые ИПСК были получены в виде перевиваемой тератокарциномы, индуцированной трансплантатом, взятым из мышиных эмбрионов[93]. Было доказано, что тератокарциномы образуются из соматических клеток[94]. Тот факт, что из клеток тератокарциномы можно получить нормальную мышь доказывал их плюрипотентность[95][96][97]. Оказалось, что клетки тератокарциномы, выделяя в культуральную среду различные факторы, способны поддерживать культуру плюрипотентных стволовых клеток эмбриона в недифференцированном состоянии[98]. Таким образом, ещё в 1980-е годы стало ясно[99][100][101], что трансплантация плюрипотентных или эмбриональных стволовых клеток во взрослый организм млекопитающих обычно приводит к образованию тератомы, которая затем может превратиться в злокачественную опухоль — тератокарциному[102]. Если, однако, поместить клетки тератокарциномы в ранний зародыш млекопитающего (на стадии бластоцисты), то они включаются в состав клеточной массы бластоцисты и из такого химерного (то есть состоящего из клеток от разных организмов) эмбриона нередко развивается нормальное химерное животное. Почти во всех органах и тканях которого часть дифференцированных клеток происходит из клеток тератокарциномы, которые совместно с клетками нормального происхождения участвуют в построении здорового организма[100][101][103]. Это свидетельствовало о том, что причиной образования тератомы является диссонанс в стадии развития донорных клеток и окружающих их клеток реципиента (так называемой ниши). Уже тогда, используя ретровирусные векторы, удалось ввести инородные гены в мышиные химеры, полученные с помощью клеток тератокарциномы[104].
Японские исследователи Такахаси и Яманака разработали систему отбора факторов плюрипотентности, использующую фибробласты, содержащие кассету устойчивости к антибиотику неомицину с промотором гена Fbx15, который активен в раннем эмбрионе, но не экспрессируется в фибробластах[105] Для индукции перепрограммирования, авторы заражали тестирующие фибробласты ретровирусными векторами, каждый из которых нес уникальную кольцевую ДНК, кодирующую ген молекулы кандидата в факторы перепрограммирования. Если ядерное перепрограммирование произошло, то эти фибробласты должны синтезировать β-галактозидазу и стать устойчивыми к высоким концентрациям неомицина[2]
В августе 2006 года японские исследователи сумели превратить клетки мышиной кожи (фибробласты) в индуцированные плюрипотентные стволовые клетки — ИПСК (induced pluripotent stem cells — iPSC), используя для модификации клетки всего четыре репрограммирующих фактора: Oct4, Klf4, Sox2 и c-Myc, доставленных в ядро ретровирусами[2]. Этим они доказали, что гиперэкспрессия небольшого количества факторов иногда может подтолкнуть клетки к переходу в новое стабильное состояние, связанному с изменениями активности тысяч генов. По своим свойствам ИПСК оказались очень похожи на эмбриональные стволовые клетки (ЭСК)[106]. Так, сравнение протеома и фосфопротеома ЭСК и ИПСК, проведенное на 4-х линиях человеческих эмбриональных стволовых клеток и 4-х линиях индуцированных плюрипотентных стволовых клеток, показало, что большинство идентифицированных белков и участков фосфорилирования в белках всех линий совпадают. Хотя были и небольшие, но статистически воспроизводимые различия, свидетельствующие об определённом функциональном различии[107]. Не было отмечено и особых изменений в последовательности ДНК, особенно если ИПСК были получены с помощью неинтегрирующихся в геном плазмид[108]. Позднее, с развитием технологии перепрограммирования, лучшим доказательством идентичности ИПСК и ЭСК стала возможность получения взрослой мыши полностью из некоторых линий ИПСК[109][110]. Несмотря на то, что рядом исследований была доказана идентичность ЭСК и ИПСК[111], получаемые клоны сильно отличаются друг от друга и не для всех из них можно доказать идентичность с ЭСК[112], далеко не все клоны способны дать жизнь химерным мышам или подвергнуться эффективной дифференциации в те или иные соматические клетки. Одной из причин таких различий является разница между составом транскрипционных факторов при репрограммировании в ИПСК и набором факторов в материнском ооците. К числу таких «упущенных» факторов относится, в частности способствующий процессу репрограммирования особый, характерный для ооцитов линкерный (связующий, компонующий нуклеосомы) гистон H1foo[113]. Замена одного из факторов Яманаки, а именно c-Myc на H1foo, значительно повысили количество и качество получаемых клонов ИПСК — они стали более однородными по свойствам, из них чаще стали получаться мыши-химеры[113].
Команда, возглавляемая Гансом Шелером (который открыл ген Oct4 в 1989 году), показала, что избыточная экспрессия Oct4 во время перепрограммирования ухудшает качество ИПСК. По сравнению с OSKM (Oct4, Sox2, Klf4 и c-Myc), которые показывают патологические модели импринтинга и дифференцировки, перепрограммирование SKM (Sox2, Klf4 и c-Myc) генерирует ИПСК с высоким потенциалом развития (почти в 20 раз выше, чем у OSKM) эквивалентно эмбриональным стволовым клеткам, что доказано по их способности генерировать мышей полностью состоящих из ИПСК посредством метода тетраплоидной комплементации эмбрионов[114][115]. Перепрограммировать клетки в ИПСК без использования Oct4 удалось и другой группе исследователей[116]
Важным преимуществом ИПСК перед ЭСК является то, что они могут быть получены из клеток взрослого организма, а не из эмбриона. Поэтому стало возможным получать ИПСК от взрослых и даже пожилых пациентов[11][117][118][119]. Перепрограммирование соматических клеток в ИПСК приводит к их омоложению о чём свидетельствуют данные исследования теломеров— концевых участков хромосом состоящих из коротких следующих друг за другом повторов эволюционно консервативной последовательности ДНК. Выяснилось, что перепрограммирование приводит к удлинению теломеров и их нормальному укорочению по мере дифференцировки ИПСК обратно в фибробласты[120]. Таким образом, при индуцированной плюрипотенции восстанавливается эмбриональная длина теломеров[121], а значит, увеличивается потенциальное число делений клетки[122][123], ограниченное так называемым лимитом Хайфлика (Hayflick limit). Более того омолаживаются и митохондрии клетки при этом восстанавливается характерный для молодых клеток уровень дыхания[124] Поэтому технологию получения ИПСК следует рассматривать как способ радикального омоложения[125]. Из-за диссонанса в стадии развития омоложенных клеток и окружающих их старых клеток реципиента, инъекция пациенту его же собственных ИПСК, обычно приводит к иммунной реакции[126], что может быть использовано в медицинских целях[127], или образованию опухолей типа тератомы[128]. Одной из причин иммуногенности аутологичных ИПСК и ЭСК считается группа из 9 генов (Hormad1, Zg16, Cyp3a11, Lce1f, Spt1, Lce3a,Chi3L4, Olr1, Retn), синтез которых повышен в тератомах, полученных из этих клеток[129][130][131] Очевидно, некоторые клетки, дифференцированные из ИПСК и ЭСК, продолжают синтезировать эмбриональные изоформы белков[132] и неадекватно интерпретируют сигналы окружающих их клеток реципиента. В связи c этим следует отметить, что образование тератомы из плюрипотентных стволовых клеток может быть вызвано низкой активностью фермента PTEN, способствующей выживанию, в процессе дифференцировки, небольшой популяции (не превышающей 0,1-5 % от общей численности клеток) высоко онкогенных клеток карциномы, инициирующих тератомы. Выживание этих инициирующих тератомы клеток связано с недостаточной репрессией Nanog, а также с повышением метаболизма глюкозы и холестерина.[133] Эти, инициирующие образование тератом, клетки характеризуются также более низким соотношением p53/p21 по сравнению с неонкогенными клетками.[134]
Недавно методом отбора удалось найти небольшие молекулы (цитотоксические селективные ингибиторы плюрипотентных стволовых клеток человека), которые предотвращают образование тератомы у мышей после трансплантации им плюрипотентных стволовых клеток человека. Самое мощное и селективное из этих соединений — PluriSIn #1, вызывало ингибирование стеароил-КоА десатуразы (ключевого фермента в биосинтезе олеиновой кислоты), что в конечном итоге приводило к апоптозу плюрипотентных стволовых клеток. С помощью этой молекулы удается выборочно удалить из культуры недифференцированные клетки.[135][136]. Ещё одной молекулой избирательно удаляющей недифференцированные клетки является STF-31,[137] являющийся ингибитором GLUT1.[138] Эффективной стратегией избирательного устранения плюрипотентных клеток, которые способны дать начало тератоме является ингибирование характерных для этих клеток антиапоптотических факторов, таких как сурвивин или Bcl10. Обработкой малыми молекулами, которые могут ингибировать эти антиапоптотические факторы, можно добиться селективного удаления подобных клеток вызвав их апоптоз. В частности, одной обработки смешанной популяции химическими ингибиторами сурвивина (такими как, например, кверцетин или YM155) достаточно чтобы вызвать избирательную и полную гибель недифференцированных клеток, вызванную накоплением р53 в митохондриах. Этого, по мнению авторов исследования, достаточно, чтобы предотвратить образование тератомы после трансплантации клеток полученных из ИПСК[139]. Тем не менее, маловероятно, что какая либо, пусть даже самая изощренная, предварительная очистка[140], способна обезопасить подсадку ИПСК или ЭСК, так как при избирательном удалении плюрипотентных клеток, они вновь довольно быстро возникают путём превращения дифференцированных клеток обратно в стволовые (к обратному переходу может в частности подтолкнуть гипоксия[141]), что приводит к образованию опухоли[142][143][144]. Это может быть связано с нарушением регуляции осуществляемой микро РНК let-7 по отношению к её мишени — белку Nr6a1 (известному также как ядерный фактор зародышевых клеток — GCNF), являющемуся эмбриональным репрессором транскрипции генов плюрипотентности, который необходим для правильной дифференцировки индуцированных плюрипотентных клеток.[145][146] Обнаружена также малая молекула названная Дисплюригеном (Displurigen), которая воздействуя на белок теплового шока HSPA8 (Heat shock 70 kDa protein 8), необходимый для связывания OCT4 с ДНК, способна вывести клетку из состояния плюрипотентности[147]. Ещё один способ предотвратить образование тератомы — это вызвать в пересаживаемой клетке ИПСК гиперэкспрессию гена CREG[148]
Использование ИПСК для клеточной терапии пока ограничено.[149] Тем не менее, они могут быть использованы для целого ряда иных целей — включая моделирование болезней, скрининг (селективный отбор) лекарств, проверку токсичности различных препаратов[150]. Важными факторами для получения высококачественных ИПСК являются определённые небольшие молекулы, способствующие сохранению геномной целостности, образующихся при перепрограммировании ИПСК, путём ингибирования двухцепочечных разрывов ДНК и активации гена Zscan4, содействующего процессам репарации ДНК[151]. Перепрограммирование вызывает репликативный стресс, который можно снизить повысив уровень чекпоинт киназы 1 (CHK1), благодаря чему повышается качество и эффективность образования ИПСК. Кроме того добавление во время перепрограммирования нуклеозидов позволяет снизить повреждения ДНК и число геномных перестроек в получаемых ИПСК[152]
Интересно отметить, что ткани, выращенные из ИПСК, помещенных в «химерные» эмбрионы на ранних стадиях развития мыши, практически не вызывают иммунного ответа (после того, как эмбрионы выросли во взрослых мышей) и пригодны для аутологичной трансплантации,[153][154] причем даже в том случае когда ИПСК получены от очень старых животных[155]. В то же время, полное перепрограммирование взрослых клеток в тканях у мышей in vivo путём временной активации факторов Oct4, Sox2, Klf4 и с-Мус, приводит к образованию в различных органах множества тератом[74]. Смотри рисунок[75]. Более того, частичное перепрограммирование клеток в ИПСК in vivo показало, что неполное перепрограммирование приводит к эпигенетическим изменениям (нарушению репрессии Поликомб целей и изменению метилирования ДНК) в клетках, которые ведут к развитию рака[156]
Индуцируемый ген клеточного самоубийства iCasp9 был сконструирован из такролимус (FK506) связывающего домена димеризации FKBP12 с мутацией F36V, повышающей его способность к связыванию индуцирующей малой молекулы; линкерной последовательности аминокислот (Ser-Gly-Gly-Gly-Ser), которая обеспечивает гибкость конструкции, и человеческого гена Casp9, в котором удален домен связывания каспазы ΔCasp9. Благодаря такой конструкции димеризация генноинженерного белка iCasp9, необходимая для активации ферментативной активности, происходит только при наличии синтетической малой молекулы (например, AP1903), вызывающей димеризацию с помощью домена FKBP12.
Алгоритм для предсказания набора транскрипционных факторов необходимых для преобразования клеток[править | править код]
Определение уникального набора транскрипционных факторов, которые необходимы для репрограммирования клеток представляет собой длительный и дорогостоящий процесс. Международная группа исследователей разработала алгоритм, называемый Магрифи (Mogrify), который помогает предсказать оптимальный набор клеточных факторов, необходимых для преобразования одного типа клеток человека в другой[157][158]. Появился также алгоритм, который предсказывает не только транскрипционные факторы необходимые для перепрограммирования, но также и идеальный выбор времени для применения этих факторов.[159][160]
Стратегии получения ИПСК для клинических испытаний[править | править код]
Разработаны критерии качества и стратегия производства ИПСК для клинических испытаний, так называемая cGMP (англ. current Good Manufacturing Practice)[161][162].
Система индуцируемого апоптоза для безопасности[править | править код]
Чтобы обезопасить применение ИПСК в клинике, было предложено одновременно с перепрограммированием клеток пациента в ИПСК, вводить в эти клетки индуцируемый малой молекулой ген каспазы-9 (IC9) для запуска каскадов апоптоза для самоубийства клеток образованных из этих ИПСК[163]. Такой «предохранитель» позволит избавляться от омоложенных клеток после того как они выполнили свою терапевтическую функцию или в случае образования опухоли из этих клеток[164][165][166][167][168].
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|