
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Комментарии 4 страница
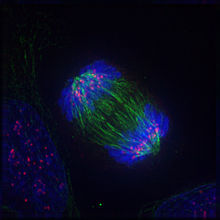
Анафаза
Анафаза — самая короткая стадия митоза, которая начинается внезапным разделением и последующим расхождением сестринских хроматид в направлении противоположных полюсов клетки.[56] Хроматиды расходятся с равномерной скоростью достигающей 0,5—2 мкм/мин[1][57] (0,2—5 мкм/мин[58]), при этом они часто принимают V-образную форму. Их движение обусловлено воздействием значительных сил, оценочно 10−5 дин на хромосому, что в 10 000 раз превышает усилие, необходимое для простого продвижения хромосомы через цитоплазму с наблюдаемой скоростью.[59]
Как правило, расхождение хромосом в анафазе состоит из двух относительно независимых процессов, называемых анафазой А и анафазой В.
Анафаза А характеризуется расхождением сестринских хроматид к противоположным полюсам деления клетки.[42] За их движение при этом отвечают те же силы, что ранее удерживали хромосомы в плоскости метафазной пластинки. Процесс расхождения хроматид сопровождается сокращением длины деполимеризующихся кинетохорных микротрубочек. Причем их распад наблюдается преимущественно (на 80 %[60]) в области кинетохоров, со стороны плюс-концов (ранее, с начала профазы и вплоть до начала анафазы, на плюс-концах преобладали процессы сборки субъединиц тубулина).[59] Вероятно, деполимеризация микротрубочек у кинетохоров либо в области полюсов деления является необходимым условием для перемещения сестринских хроматид, так как их движение прекращается при добавлении таксола или тяжёлой воды (D2O), оказывающих стабилизирующее воздействие на микротрубочки. Механизм, лежащий в основе расхождения хромосом в анафазе А, пока остается неизвестным.[~ 4][59]
Во время анафазы В расходятся сами полюса деления клетки,[42] и, в отличие от анафазы А, данный процесс происходит за счёт сборки полюсных микротрубочек со стороны плюс-концов. Полимеризующиеся антипараллельные нити веретена при взаимодействии отчасти и создают расталкивающее полюса усилие. Величина относительного перемещения полюсов при этом, также как и степень перекрывания полюсных микротрубочек в экваториальной зоне клетки, сильно варьирует у особей разных видов.[61] Помимо расталкивающих сил, на полюса деления воздействуют тянущие силы со стороны астральных микротрубочек, которые создаются в результате взаимодействия с динеино-подобными белками на плазматической мембране клетки.[62]
Последовательность, продолжительность и относительный вклад каждого из двух процессов, слагающих анафазу, могут быть крайне различны. Так, в клетках млекопитающих анафаза В начинается сразу вслед за началом расхождения хроматид к противоположным полюсам и продолжается вплоть до удлинения митотического веретена в 1,5—2 раза по сравнению с метафазным. В некоторых других клетках (например, дрожжевых) анафаза В начинается только после того как хроматиды достигают полюсов деления. У некоторых простейших в процессе анафазы В веретено удлиняется в 15 раз по сравнению с метафазным.[56] В растительных клетках анафаза В отсутствует.[62]
Телофаза[править | править код]
Основная статья: Телофаза
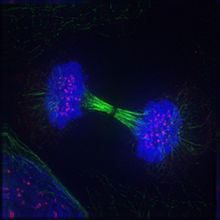
Телофаза
Телофаза (от греч. τέλος — конец) рассматривается как заключительная стадия митоза; за её начало принимается момент остановки разделённых сестринских хроматид у противоположных полюсов деления клетки.[62] В ранней телофазе наблюдается деконденсация хромосом и, следовательно, увеличение их в объёме. Вблизи сгруппированных индивидуальных хромосом начинается слияние мембранных пузырьков, что дает начало реконструкции ядерной оболочки. Материалом для построения мембран новообразованных дочерних ядер служат фрагменты изначально распавшейся ядерной мембраны материнской клетки, а также элементы эндоплазматического ретикулума.[63] При этом отдельные пузырьки связываются с поверхностью хромосом и сливаются воедино. Постепенно восстанавливается наружная и внутренняя ядерные мембраны, восстанавливаются ядерная ламина и ядерные поры. В процессе восстановления ядерной оболочки дискретные мембранные пузырьки, вероятно, соединяются с поверхностью хромосом без распознавания специфических последовательностей нуклеотидов, так как в результате проведенных экспериментов было выявлено, что восстановление ядерной мембраны происходит вокруг молекул ДНК, заимствованных у любого организма, даже у бактериального вируса.[64] Внутри заново сформировавшихся клеточных ядер хроматин переходит в дисперсное состояние, возобновляется синтез РНК, и становятся различимыми ядрышки.
Параллельно с процессами образования ядер дочерних клеток в телофазе начинается и заканчивается разборка микротрубочек веретена деления. Деполимеризация протекает в направлении от полюсов деления к экваториальной плоскости клетки, от минус-концов к плюс-концам. При этом дольше всего сохраняются микротрубочки в средней части веретена деления, которые образуют остаточное тельце Флемминга.[65]
Цитокинез[править | править код]
Основная статья: Цитокинез
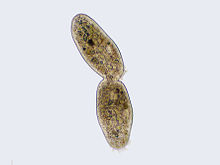
Деление клетки инфузории завершается цитокинезом
Окончание телофазы преимущественно совпадает с разделением тела материнской клетки — цитокинезом (цитотомией).[66][67] При этом образуются две или более дочерние клетки. Процессы, ведущие к разделению цитоплазмы, берут своё начало ещё в середине анафазы и могут продолжаться после завершения телофазы. Митоз не всегда сопровождается разделением цитоплазмы, поэтому цитокинез не классифицируется в качестве отдельной фазы митотического деления и обычно рассматривается в составе телофазы.[~ 5]
Различают два основных типа цитокинеза: деление поперечной перетяжкой клетки (наиболее характерно для клеток животных) и деление путём образования клеточной пластинки (свойственно растениям в связи с наличием жёсткой клеточной стенки). Плоскость деления клетки детерминируется положением митотического веретена и проходит под прямым углом к длинной оси веретена.[68]
При делении поперечной перетяжкой клетки место разделения цитоплазмы закладывается предварительно ещё в период анафазы, когда в плоскости метафазной пластинки под мембраной клетки возникает сократительное кольцо из актиновых и миозиновых филаментов. В дальнейшем, вследствие активности сократительного кольца, образуется борозда деления, которая постепенно углубляется вплоть до полного разделения клетки. По окончании цитокинеза сократимое кольцо полностью распадается, а плазматическая мембрана стягивается вокруг остаточного тельца Флемминга, состоящего из скопления остатков двух групп полюсных микротрубочек, тесно упакованных вместе с материалом плотного матрикса.[69]
Деление путём образования клеточной пластинки начинается с перемещения мелких ограниченных мембраной пузырьков по направлению к экваториальной плоскости клетки. Здесь они сливаются, образуя дисковидную, окружённую мембраной структуру — раннюю клеточную пластинку. Мелкие пузырьки происходят в основном из аппарата Гольджи и перемещаются к экваториальной плоскости вдоль остаточных полюсных микротрубочек веретена деления, образующих цилиндрическую структуру, называемую фрагмопластом. По мере расширения клеточной пластинки микротрубочки раннего фрагмопласта попутно перемещаются к периферии клетки, где за счёт новых мембранных пузырьков продолжается рост клеточной пластинки вплоть до её окончательного слияния с мембраной материнской клетки. После окончательного разделения дочерних клеток в клеточной пластинке откладываются микрофибриллы целлюлозы, завершая образование жёсткой клеточной стенки.[70]
Регуляция митоза[править | править код]
Основными регулято́рными механизмами митоза являются процессы фосфорилирования и протеолиза[71]. Обратимые реакции фосфорилирования и дефосфорилирования обеспечивают протекание обратимых событий митоза, таких как сборка/распад веретена деления или распад/восстановление ядерной оболочки. Протеолиз лежит в основе необратимых событий митоза, таких как разделение сестринских хроматид в анафазе или разрушение митотических циклинов на поздних стадиях митоза.
Контрольные точки[править | править код]
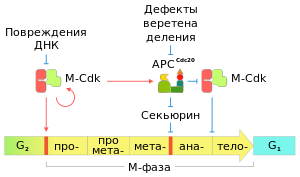
Общая схема регуляции митоза[72]
Рассматривая вопрос регуляции митоза, можно условно выделить два периода митотического деления: от начала профазы до анафазы, и далее, от анафазы до конца телофазы[73]. Каждый из двух обозначенных периодов начинается с прохождения контрольной точки клеточного цикла.
Первой контрольной точкой является переход из фазы G2 к M-фазе. Главным условием для преодоления контрольной точки G2/M является завершённая репликация ДНК: старт митотического деления блокируется у большинства эукариот при повреждениях или неоконченной репликации ДНК. События от начала профазы и до окончания метафазы инициируются и протекают при участии белковых комплексов, состоящих из митотических циклинов и циклин-зависимых киназ (англ. M-Cdk).
Вторая контрольная точка служит разделительным барьером на границе метафазы и анафазы. На данном этапе критичным показателем является состояние веретена деления: вступление в анафазу у всех эукариот блокируется в случае наличия дефектов веретена. Ключевым активатором событий анафазы является убиквитинлигаза APCCdc20[72].
Основные регуляторы митоза[править | править код]
Циклин-киназы[править | править код]
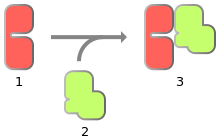
Схема активации циклин-зависимой киназы:
1 — неактивная циклин-зависимая протеинкиназа;
2 — циклин;
3 — активный циклин-киназный комплекс
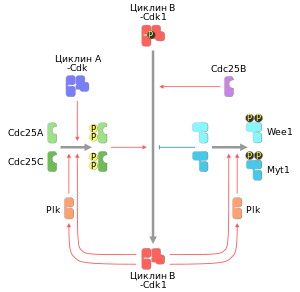
Принцип положительной обратной связи при активации митоза: путём фосфорилирования циклин-киназный комплекс циклин B — Cdk1 стимулирует его собственные активаторы семейства Cdc25 и подавляет работу его ингибиторов семейства Wee1. В качестве возможных инициаторов петли обратной связи указаны фосфатаза Cdc25B и комплекс циклин A — Cdk[74]
Ключевыми активаторами митоза, обеспечивающими инициацию событий профазы—метафазы, являются циклин-киназные комплексы (англ. M-Cdk). Данные комплексы представляют собой гетеродимеры, состоящие из двух субъединиц: регуляторной — митотического циклина (англ. M cyclin) и каталитической — циклин-зависимой киназы (англ. Cdk — cyclin-dependent kinase).
В регуляцию митоза у всех эукариот вовлечена циклин-зависимая киназа Cdk1,[75] которая представляет собой фермент (фосфорилазу), модифицирующий белки за счёт переноса фосфатной группы от АТФ на аминокислоты серин и треонин. Концентрация Cdk1 постоянна на протяжении всего клеточного цикла,[76] поэтому активность циклин-зависимой киназы в процессе митоза зависит главным образом от её соединения с митотическим циклином. Концентрация митотических циклинов увеличивается по мере приближения к митозу и достигает максимума в метафазе. Различным таксонам свойственны различные митотические циклины. Так, у почкующихся дрожжей в регуляцию митоза вовлечены четыре циклина Clb1, 2, 3 и 4; у дрозофилы — циклины A, B, B3; у позвоночных — циклин B.[77]
Регуляторы активности циклин-киназ[править | править код]
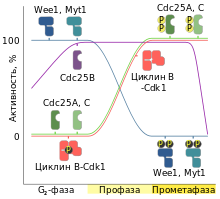
Активность основных регуляторов митоза на стадии профазы (на примере позвоночных). Синим цветом обозначен график активности ингибиторов семейства Wee1 (Wee1, Myt1). Зелёным цветом обозначен график активности фосфатаз семейства Cdc25 (Cdc25A, Cdc25C). График активности комплекса циклин B-Cdk1 обозначен красным цветом. Отдельно фиолетовым цветом обозначен график активности фосфатазы Cdc25B[78]
Накопление митотических циклинов начинается ещё на стадии G2. Увеличение концентрации циклинов обеспечивается за счёт транскрипции соответствующих им генов.[79] Новосинтезированные циклины сразу объединяются с неактивной киназой Cdk1. Однако образующиеся при этом циклин-киназные комплексы сохраняются в неактивном состоянии до момента активации митоза. Сдерживание активности комплексов M-Cdk1 на протяжении фазы G2 осуществляется благодаря ингибирующему фосфорилированию молекулы Cdk1.[80] За ингибирование Cdk1 ответственна группа протеинкиназ семейства Wee1.[77][79] В итоге, к началу митоза в клетке накапливается значительное количество неактивных комплексов M-Cdk1.
Собственно начало профазы на молекулярном уровне знаменуется резкой активацией киназных комплексов M-Cdk1. В основе скачкообразного увеличения активности M-Cdk1 лежат как минимум два взаимосвязанных события. Во-первых, к началу профазы приурочена активация фосфатаз семейства Cdc25, которые освобождают комплекс M-Cdk1 от ингибирующих фосфатных групп. Во-вторых, активированные таким образом киназы M-Cdk1 включаются в цепочку положительной обратной связи: путём фосфорилирования они активируют собственных активаторов семейства Cdc25 и ингибируют собственных ингибиторов семейства Wee1. В итоге, в начале профазы наблюдается взаимосвязанное увеличение активности фосфатаз семейства Cdc25 и циклин-киназ M-Cdk1 на фоне параллельного снижения активности ингибиторов семейства Wee1. Таким образом, в основу активации митоза заложен принцип положительной обратной связи. Но, несмотря на то, что уже известно об инициирующих механизмах митоза, остаётся до сих пор неясно, какой именно стимул изначально активирует Cdc25 или Cdk1, тем самым обеспечивая запуск цепочки положительной обратной связи.[~ 6][79][82]
Polo- и aurora-подобные киназы[править | править код]
Помимо циклин-зависимых киназ в регуляцию митотических событий вовлечены как минимум ещё два типа киназ: polo-подобные киназы и киназы семейства aurora. Polo-подобные киназы (англ. polo-like kinase, Plk) представляют собой серин-треониновые протеинкиназы, активирующиеся на начальных и инактивирующиеся на поздних стадиях митоза или в начале фазы G1. Данные киназы вовлечены в различные митотические процессы: сборку веретена деления, функционирование кинетохора, цитокинез.[83] Киназы семейства aurora также относятся к группе серин-треониновых протеинкиназ. У многоклеточных выделяются два основных представителя данного семейства: aurora A и aurora B. Киназа aurora A участвует в регуляции функционирования центросом и митотического веретена. Киназа aurora B участвует в регуляции процессов конденсации и разделения сестринских хроматид, а также обеспечивает присоединение кинетохоров к микротрубочкам веретена деления.[84]
Активатор анафазы APCCdc20[править | править код]

Комплекс стимуляции анафазы[85]
Комплекс, стимулирующий анафазу (англ. anaphase-promoting complex, APC), также называемый циклосома, представляет собой крупное белковое соединение, которому отводится решающая роль в активации анафазы. Функционально комплекс стимуляции анафазы представляет собой убиквитинлигазу и катализирует реакции присоединения молекул убиквитина к различным целевым белкам, которые в итоге подвергаются протеолизу.[86]
В структуре комплекса стимуляции анафазы выделяется порядка 11—13 субъединиц. Ядро комплекса составляют: субъединица куллина (Apc2) и RING-домен (Apc11), к которому присоединяется убиквитин-конъюгирующий фермент (E2). Функционирование комплекса регулируется за счёт присоединения активирующей субъединицы в нужный момент клеточного цикла.[85]
Белок Cdc20 (англ. cell division cycle protein 20 — «белок клеточного цикла 20») активирует комплекс APC при переходе делящейся клетки из метафазы в анафазу. Происходит это следующим образом. На стадии метафазы циклин-киназный комплекс M-Cdk путём фосфорилирования трансформирует ядро комплекса APC. В результате указанного конформационного изменения повышается вероятность присоединения активатора Cdc20. В итоге, активированный комплекс APCCdc20 обретает убиквитин-лигазную активность и убиквитинирует свои главные цели — секьюрин и митотические циклины.[85]
Секьюрин (одна из главных мишеней APCCdc20) представляет собой ингибирующий белок, сдерживающий в неактивном состоянии фермент сепаразу. Вследствие реакции убиквитинирования секьюрин разрушается, а высвободившаяся при этом сепараза разрушает когезин. После деградации когезина, обеспечивающего сцепление сестринских хроматид, происходит разделение и расхождение хромосом к полюсам деления клетки.[87]
Убиквитинирование и, как следствие, разрушение митотических циклинов (ещё одной важной мишени APCCdc20) запускает цепочку отрицательной обратной связи. Выглядит это следующим образом. Циклин-киназный комплекс M-Cdk активирует убиквитин-лигазный комплекс APCCdc20, который целенаправленно разрушает митотические циклины, что ведёт к деградации циклин-киназного комплекса M-Cdk, то есть цепочка реакций приводит к разрушению изначального активатора этой цепочки. Но поскольку активность APCCdc20 зависит от комплекса M-Cdk, инактивация циклин-киназы M-Cdk приводит к инактивации APCCdc20. В итоге APCCdc20 деактивируется к концу митоза.[85]
Митотический кроссинговер[править | править код]
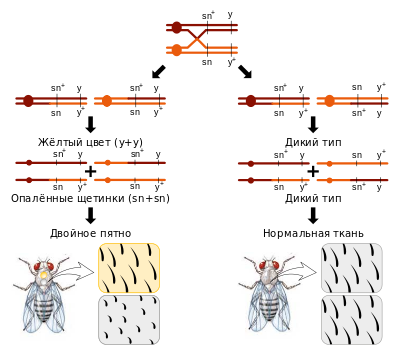
Схема одного из вариантов митотического кроссинговера. На схеме также отражено, что результат митотического кроссинговера зависит от ориентации хроматид в метафазе и, соответственно, их распределения в анафазе
Основная статья: Митотический кроссинговер
Митотический кроссинговер — процесс обмена участками гомологичных хромосом в процессе митотического деления. Относительно редкий тип генетической рекомбинации в соматических клетках, по причине отсутствия нормального механизма конъюгации хромосом.[88][89] Частота митотического кроссинговера составляет не более одного раза на миллион клеточных делений[90] (1,3±0,1 на 106 клеточных делений[91]). У некоторых диплоидных грибов частота митотической рекомбинации может достигать 1—10 % от частоты мейотического кроссинговера.[92] Воздействие радиации или химических реагентов может повысить частоту митотической рекомбинации. Некоторые исследователи предполагают сходство механизмов мейотического и митотического кроссинговера.[91]
Первые данные о существовании митотической рекомбинации были получены генетиком Куртом Штерном в 1936 году. Учёный проводил исследования на плодовых мушках и обратил внимание на локальное проявление рецессивных признаков у гетерозиготных особей. То есть у мух с нормальным внешним покровом появлялись участки ткани с жёлтым окрасом или с «опалёнными» щетинками. Однако оба признака кодировались генами, локализованными в пределах одной хромосомы, и у гетерозиготных особей не должны были проявляться. Особо любопытны оказались случаи «двойных пятен», при которых проявлялись сразу оба рецессивных признака, причём у особей как женского, так и мужского пола. В итоге, на основе полученных данных был сделан вывод о существовании митотической рекомбинации в соматических клетках.[90][91]
Патология митоза[править | править код]
Патология митоза развивается при нарушении нормального течения митотического деления и зачастую приводит к возникновению клеток с несбалансированными кариотипами, следовательно, ведёт к развитию мутаций и анеуплоидии. Также в результате развития отдельных форм патологии наблюдаются хромосомные аберрации. Незавершённые митозы, прекращающиеся по причине дезорганизации или разрушения митотического аппарата, приводят к образованию полиплоидных клеток. Полиплоидия и формирование дву- и многоядерных клеток возникают в случае нарушений механизмов цитокинеза. При значительных последствиях патологии митоза возможна гибель клетки.
В нормальных тканях патология встречается в незначительных количествах. Например, в эпидермисе мышей встречается около 0,3 % патологических митозов; в эпителии гортани и матки человека — около 2 %. Патологические митозы часто наблюдаются при канцерогенезе, при различных экстремальных воздействиях, при лучевой болезни или вирусной инфекции,[~ 7] при раке и предраковых гиперплазиях.[~ 8] Частота патологических митозов также увеличивается с возрастом.[95]
Условно различают патологию митоза функционального и органического типа. К функциональным нарушениям относят, например, гипореактивность вступающих в митоз клеток — снижение реакции на физиологические регуляторы, определяющие интенсивность пролиферации нормальных клеток. Органические нарушения возникают при повреждении структур, участвующих в митотическом делении (хромосомы, митотический аппарат, клеточная поверхность), а также при нарушении процессов, связанных с данными структурами (репликация ДНК, образование веретена деления, движение хромосом, цитокинез).[95]
Классификация и общая характеристика различных форм патологий митоза[править | править код]
На основании морфологических признаков и цитохимических нарушений митотического процесса выделяют три основных группы патологий митоза: патология, связанная с повреждением хромосом; патология, связанная с повреждением митотического аппарата; нарушение цитокинеза[96].
I. Патология митоза, связанная с повреждением хромосом[править | править код]
1) Задержка митоза в профазе наблюдается при нарушениях репликации ДНК.
2) Нарушение спирализации и деспирализации хромосом прослеживается в результате действия на делящуюся клетку различными митотическими ядами. Например, воздействие колхицина приводит к гиперспирализации хромосом, которые приобретают укороченную и утолщенную форму[96].
3) Раннее (преждевременное) разделение хроматид в профазе (в норме разделение хроматид происходит на рубеже перехода метафазы в анафазу). Обозначенная патология наблюдается, к примеру, при изменении осмотического давления в фибробластах кролика в культуре ткани или же при воздействии канцерогенов (бензпирена, метилхолантрена) на мышиные фибробласты[96].
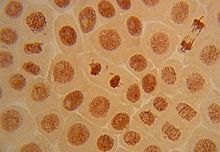
В центральной делящейся клетке, находящейся в стадии телофазы, наблюдается парный фрагмент. Микрофотография сделана во время проведения эксперимента Allium test
В центре клеточного поля видна делящаяся клетка в стадии анафазы. Отчётливо заметен хроматидный мост и одиночный фрагмент хромосомы. Микрофотография сделана во время проведения эксперимента Allium test по изучению влияния активного излучения сотового телефона на клетки in vivo
4) Фрагментация и пульверизация хромосом возникает в опухолевых клетках, при вирусной инфекции, в результате воздействия на нормальные клетки ионизирующего излучения или мутагенов. Фрагменты могут быть одиночными, парными и множественными. Те из них, которые лишены центромерного участка, не участвуют в метакинезе, и, соответственно, не расходятся к полюсам деления в анафазе. При массовой фрагментации хромосом (пульверизация) большинство фрагментов также беспорядочно рассеиваются в цитоплазме и не участвуют в метакинезе[97].
В итоге часть фрагментов хромосом может попасть в одно из дочерних ядер, либо резорбироваться, либо образовать обособленное микроядро. Также отдельные фрагменты обладают способностью воссоединяться своими концами, причём подобные воссоединения носят случайный характер и приводят к хромосомным аберрациям[98].
5) Хромосомные и хроматидные мосты являются следствием фрагментации хромосом. При воссоединении фрагментов содержащих центромер образуется дицентрическая хромосома, которая в ходе анафазы растягивается между противоположными полюсами деления, образуя мост. Хромосомный (обычно двойной) мост возникает в результате воссоединения фрагментов хромосом, каждый из которых образован двумя хроматидами с центромерой. Хроматидный (обычно одиночный) мост возникает в результате воссоединения двух фрагментов отдельных хроматид с центромерой[99].
К концу анафазы — в начале телофазы мосты обычно быстро рвутся в результате чрезмерного растягивания дицентрических фрагментов хромосом. Образование мостов приводит к генотипической разнородности дочерних клеток, а также нарушает течение завершающих стадий деления и задерживает цитокинез[99].
6) Отставание хромосом в метакинезе и при расхождении к полюсам возникает при повреждении хромосом в области кинетохора. Поврежденные хромосомы пассивно «дрейфуют» в цитоплазме и в итоге либо разрушаются и элиминируются из клетки, либо случайным образом попадают в одно из дочерних ядер, либо образуют отдельное микроядро. Отставание хромосом наблюдалось в культурах ткани опухолевых клеток, а также в экспериментах, в ходе которых кинетохоры хромосом облучались микропучком ультрафиолетовых лучей[100].
7) Образование микроядер происходит вследствие фрагментации или отставания отдельных хромосом, вокруг которых в телофазе формируется ядерная оболочка, параллельно образованию оболочки вокруг основных дочерних ядер. Новообразованные микроядра либо сохраняются в клетке в течение всего дальнейшего клеточного цикла вплоть до очередного деления, либо подвергаются пикнозу, разрушаются и выводятся из клетки[100].
8) При нерасхождении хромосом сестринские хроматиды не разъединяются с началом анафазы и вместе отходят к одному из полюсов, что приводит к анеуплоидии[101].
9) Набухание и слипание хромосом наблюдается в опухолевых клетках и при воздействии токсических доз различных митотических ядов. Вследствие набухания хромосомы теряют свои нормальные очертания и слипаются, превращаясь в комковатые массы. Расхождения хромосом не происходит и клетки в таком состоянии зачастую погибают[101].
II. Патология митоза, связанная с повреждением митотического аппарата[править | править код]
1) Задержка митоза в метафазе характерна для всей группы патологий митоза, связанных с повреждением митотического аппарата.
2) Колхициновый митоз или к-митоз — одна из форм патологии митоза, связанная с повреждением митотического аппарата вследствие воздействия статмокинетических ядов (колхицина, колцемида, винбластина, винкристина, аценафтена, нокодазол, метанола и др.)[102]. В результате воздействия статмокинетических ядов митоз задерживается на стадии метафазы в связи с дезорганизацией различных компонентов митотического веретена деления — центриолей, микротрубочек, кинетохоров. Повреждения также затрагивают клеточное ядро, плазмалемму, различные внутриклеточные органоиды (митохондрии, хлоропласты, аппарат Гольджи). Действие статмокинетических ядов усиливает спирализацию хромосом, что приводит к их укорочению и утолщению, а порой доводит до набухания и слипания хромосом. Как следствие, происходят хромосомные аберрации, образуются микроядра в результате фрагментации или отставания хромосом, развивается анеуплоидия[103].
Исход к-митоза зависит от дозы и времени воздействия статмокинетического яда на делящуюся клетку. При токсических дозах наблюдается пикноз ядра и гибель клетки. Значительные отравления приводят к полиплоидизации. Воздействие небольших доз обратимо. В течение нескольких часов может восстановиться митотический аппарат и продолжиться митотическое деление[103].
3) Рассеивание хромосом в метафазе происходит в результате повреждения или полной дезорганизации митотического аппарата.
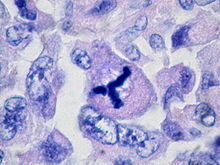
Трёхполюсный митоз в клетке рака молочной железы
4) Многополюсный митоз связан с аномалией репродукции центриолей, что ведет к формированию дополнительных полюсов и веретен деления. В итоге хромосомы распределяются неравномерно между дочерними ядрами, что, в свою очередь, ведет к образованию анеуплоидных клеток с несбалансированным набором хромосом[104].
5) Моноцентрический митоз связан с нарушением разделения центриолей. При этом формируется лишь один полюс, от которого расходятся нити единственного полуверетена. В итоге моноцентрический митоз приводит к полиплоидизации[105].
6) Асимметричный митоз характеризуется непропорциональным развитием противоположных полюсов деления, что приводит к неравномерному распределению хромосом между дочерними ядрами, то есть к анеуплоидии[105]. В результате асимметричный митоз приводит к образованию микроклеток и гигантских клеток с гипо- и гиперплоидными ядрами.
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|