
- Автоматизация
- Антропология
- Археология
- Архитектура
- Биология
- Ботаника
- Бухгалтерия
- Военная наука
- Генетика
- География
- Геология
- Демография
- Деревообработка
- Журналистика
- Зоология
- Изобретательство
- Информатика
- Искусство
- История
- Кинематография
- Компьютеризация
- Косметика
- Кулинария
- Культура
- Лексикология
- Лингвистика
- Литература
- Логика
- Маркетинг
- Математика
- Материаловедение
- Медицина
- Менеджмент
- Металлургия
- Метрология
- Механика
- Музыка
- Науковедение
- Образование
- Охрана Труда
- Педагогика
- Полиграфия
- Политология
- Право
- Предпринимательство
- Приборостроение
- Программирование
- Производство
- Промышленность
- Психология
- Радиосвязь
- Религия
- Риторика
- Социология
- Спорт
- Стандартизация
- Статистика
- Строительство
- Технологии
- Торговля
- Транспорт
- Фармакология
- Физика
- Физиология
- Философия
- Финансы
- Химия
- Хозяйство
- Черчение
- Экология
- Экономика
- Электроника
- Электротехника
- Энергетика
Семинар по теме: «Химия элементов I,IIА-групп»
Семинар по теме: «Химия элементов I,IIА-групп»
Вопросы и задачи
Вопросы
1. Малорастворимые соли лития: фторид, карбонат, ортофосфат. Способы получения в лаборатории. Как объяснить, что соли лития, в отличие от солей других щелочных металлов хорошо растворяются в органических растворителях? (лаб. журнал)
2. Опишите процесс разделения катионов Ba2+ и Sr2+ при их совместном присутствии в растворе. (лаб. журнал)
Задачи
1. Осуществите следующие превращения (укажите условия проведения реакций; число стадий должно быть минимальное):
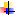 KCl → K → KO3 → KAl(SO4)2∙12H2O → K2S
KCl → K → KO3 → KAl(SO4)2∙12H2O → K2S
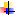 Na → Na2SO4 → Na2S → Na2CO3 → NaOH → Na
Na → Na2SO4 → Na2S → Na2CO3 → NaOH → Na
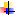 LiOH → LiCl → Li2CO3 → Li2O → X → Li → LiNH2
LiOH → LiCl → Li2CO3 → Li2O → X → Li → LiNH2
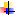 Na2SO4 → Na2CO3 → NaOH → NaClO3 → NaCl → NaHCO3 → Na2CO3
Na2SO4 → Na2CO3 → NaOH → NaClO3 → NaCl → NaHCO3 → Na2CO3
2. Осуществите следующие превращения (укажите условия проведения реакций; число стадий должно быть минимальное):
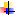 Be(NO3)2
Be(NO3)2 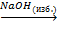 X1
X1  X2
X2  BeCl2
BeCl2
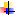 MgCl2
MgCl2  MgCO3
MgCO3  MgO
MgO  Mg
Mg  MgCl2(безв.)
MgCl2(безв.)
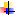 BaCl2
BaCl2  BaSO3
BaSO3  BaSO4
BaSO4 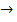 X
X  BaCl2
BaCl2  BaCO3
BaCO3
3. С позиции протолитической теории Бренстеда – Лоури напишите уравнения реакций гидролиза следующих солей: Na2CO3, NaHCO3. Укажите значение pH в растворах данных солей. Используя полное математическое выражение закона разбавления Оствальда, рассчитайте значение степени протолиза в водном растворе карбоната натрия с концентрацией 0,001м моль/л.
4. Нитрид лития массой 5,5 г обработали водой и довели объем раствора до 2 л. Рассчитайте pH в конечном растворе.
5. Рассчитайте значение pH, при котором осаждается гидроксид магния из 0,1М раствора хлорида магния.
Вопрос 1. Малорастворимые соли лития: фторид, карбонат, ортофосфат. Способы получения в лаборатории.
К малорастворимым солям лития относится фторид, карбонат и ортофосфат лития.
Фторид лития получают путем осаждения из водных растворов действием на хорошо растворимые соли лития концентрированным раствором фторида натрия или аммония. Со временем в насыщенном растворе фторида лития устанавливается гетерогенное равновесие между твердой фазой и ионами, перешедшими в раствор:
Li+ + F- = LiF↓
LiF(тв.) ↔ Li+ + F-; ПР = 1,5·10-3
Условие осаждение имеет вид: c(Li+) 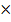 c(F-)
c(F-) 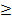 ПР
ПР
Карбонат лития получают путем осаждения из водных растворов действием на хорошо растворимые соли лития концентрированным раствором карбоната натрия. Наиболее полное осаждение карбоната лития достигается путем кипячения раствора, поскольку растворимость его с повышением температуры уменьшается:
Li+ + CO32- = Li2CO3↓
Li2CO3(тв.) 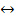 2Li+ + CO32-; ПР = 1,9·10-3
2Li+ + CO32-; ПР = 1,9·10-3
Условие осаждения имеет вид: c(Li+)2 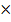 c(CO32-)
c(CO32-) 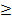 ПР
ПР
Ортофосфат лития можно получить:
 действием на хорошо растворимые соли лития ортофосфатом калия или натрия:
действием на хорошо растворимые соли лития ортофосфатом калия или натрия:
3Li+ + PO43- = Li3PO4↓
 действием на хорошо растворимые соли лития гидроортофосфатом калия или натрия:
действием на хорошо растворимые соли лития гидроортофосфатом калия или натрия:
3Li+ + 2HPO42- = Li3PO4↓ + H2PO4-
Li3PO4(тв.) ↔ 3Li+ + PO43-; ПР = 3,2·10-9
В первом случае будет наблюдаться обильное выпадение осадка, тогда как во втором случае будет наблюдаться лишь легкое помутнение раствора.
Причину данного явления легко объяснить, если рассмотреть протолитические свойства гидроортофосфат – иона. Гидроортофосфат – ион в водном растворе проявляет свойства амфолита с преобладанием основных свойств. Таким образом, концентрация ортофосфат иона понижена по сравнению с концентрацией гидроортофосфат – иона. Поэтому условие осаждение в данном случае лишь незначительно превышает величину ПР, поэтому наблюдается лишь легкое помутнение раствора. Добиться наиболее полного осаждения можно путем добавления в данную систему гидроксида натрия или калия. При введении в систему электролита, содержащего одноименные ионы, сместит протолитическое равновесие в сторону исходных веществ, что приведет к увеличению концентрации гидроортофосфат-иона, а это, в свою очередь, повлечет за собой смещение протолитического равновесия по кислотному типу в сторону продуктов реакции, т.е. в сторону увеличения концентрации ортофосфат-ионов. При достаточном добавлении щелочи возможно наиболее полное осаждение ортофосфата лития.
а) HPO42- + H2O ↔ H2PO4- + OH-
Kb(H2PO4-/HPO42-) = 1,62·10-7
б) HPO42- + H2O ↔ PO43- + H3O+
Ka(HPO42-/PO43-) = 4,57·10-13
Kb(H2PO4-/HPO42-) 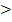 Ka(HPO42-/PO43-), следовательно,
Ka(HPO42-/PO43-), следовательно,
[PO43-] 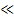 [H2PO4-]
[H2PO4-] 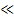 [HPO42-]
[HPO42-]
Вводим в систему гидроксид щелочного металла:
NaOH = Na+ + OH-
3Li+ + HPO42- + OH- = Li3PO4↓ + H2O
Вопрос 2. Опишите процесс разделения катионов Ba2+ и Sr2+ при их совместном присутствии в растворе.
Разделение катионов Sr2+ и Ba2+ при их совместном присутствии в растворе основано на различном отношении их малорастворимых хроматов к уксусной кислоте. Таким образом, вначале проводят осаждение катионов Ba2+ и Sr2+ хроматом калия. В результате протекания химической реакции в осадок выпадают малорастворимые хроматы стронция и бария, окрашенные в желтый цвет:
а) Ba2+ + CrO42- = BaCrO4↓
BaCrO4(тв.) ↔ Ba2+ + CrO42-; ПР = 1,1·10-10
б) Sr2+ + CrO42- = SrCrO4↓
SrCrO4(тв.) ↔ Sr2+ + CrO42-; ПР = 2,7· 10-5
Затем полученную смесь осадков обрабатывают уксусной кислотой. Поскольку ПР хромата стронция почти в два раза больше хромата бария, следовательно, возможно его растворение в слабой уксусной кислоте. Другой причиной его растворения является превращение хромат – ионов в дихромат – ионы в кислотной среде:
2CrO42- + 2H3O+ ↔ Cr2O72- + 3H2O
При добавлении уксусной кислоты фазовое равновесие
SrCrO4(тв.) ↔ Sr2+ + CrO42- смещается в сторону продуктов реакции, поскольку концентрация хромат - ионов понижается; c(Sr2+)2  c(CrO42-)
c(CrO42-)  ПР. В результате протекания химической реакции масса осадка уменьшается, в растворе повышается концентрация Sr2+ и Cr2O72-; при достаточном количестве уксусной кислоты весь осадок растворится:
ПР. В результате протекания химической реакции масса осадка уменьшается, в растворе повышается концентрация Sr2+ и Cr2O72-; при достаточном количестве уксусной кислоты весь осадок растворится:
2SrCrO4 + 2CH3COOH = 2Sr2+ + 2CH3COO- + Cr2O72- + H2O
Достигнуть при помощи уксусной кислоты столь сильного смещения равновесия в случае хромата бария не удается. В то же время добавление сильной кислоты приводит к полному растворению хромата бария:
2BaCrO4 + 2HCl = BaCl2 + BaCr2O7 + H2O
|
|
|
© helpiks.su При использовании или копировании материалов прямая ссылка на сайт обязательна.
|